SUMMARY
Lispro insulin in an insulin analogue used for the treatment of postprandial glycemia excursions. Nowadays, there are a lot of information about its efficacy and safety in the treatment of type 1 and type 2 diabetic patients. Although it has particular pharmacological properties and specific clinical applications, lispro insulin can't demonstrate to be better than human regular insulin in the improvement of metabolic control in diabetic populations.
ANTECEDENTES
Desde el descubrimiento de la insulina en la segunda década del siglo XX, la comunidad científica involucrada en la tratamiento de la diabetes mellitus se ha visto enfrentada continuamente a un reto: simular mediante la aplicación de insulina exógena la compleja función euglicemiante del páncreas. Durante décadas se ha logrado prolongar la vida media de la insulina mediante la adicción de diferentes compuestos químicos como el zinc o la protamina a la insulina porcina, bovina o humana. De este modo se alimentó falsamente la expectativa de que la mayoría de los pacientes diabéticos podían ser tratados con una única dosis de insulina al día. Luego de la aparición de los primeros resultados del estudio DCCT en 1993 45, se demostró la inoperancia de esta modalidad terapéutica y quedó patente la necesidad de al menos tres inyecciones diarias de insulina para obtener un control glucémico capaz de evitar la morbi-mortalidad derivada de la hiperglucemia crónica en el paciente diabético tipo 1. La revolución tecnológica de que hemos sido testigos en la última década ha permitido un conocimiento certero y preciso de la fisiología de la célula beta y de su intrincado entorno celular 42. Así pues, está claro que la secreción insulínica tiene 2 patrones definidos: uno basal y otro postprandial, ambos regulados de forma precisa por diversidad de factores neurohormonales 39. Del conocimiento y estudio de este conjunto de complejas interacciones entre el microambiente del islote de Langerhans, los órganos diana de la insulina y la ingesta alimenticia nació la necesidad de fabricar insulinas específicamente dirigidas a reemplazar la secreción fisiológica de insulina en el estado basal y en el postprandial, tratando de prevenir de esta forma la gluconeogénesis hepática excesiva y las excursiones glucémicas postprandiales exageradas que supone un estado insulinopénico. 37 Los análogos de la insulina han venido a complementar el arsenal terapéutico del diabetólogo. Los análogos de vida media prolongada, como la insulina glargina y la detemir 36, han sido diseñados para suplir la secreción basal de insulina. Los análogos de insulina de vida media corta, como la insulina Lispro y la Aspart, están focalizados hacia el control de la glucemia postprandial.
FARMACOLOGÍA BÁSICA
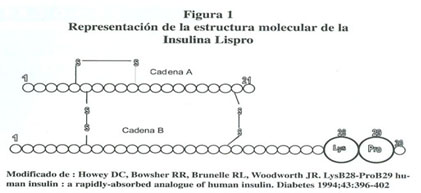
La insulina humana está compuesta por dos cadenas. La cadena A cuenta con 21 residuos de aminoácidos y la B con 30. Existen dos puentes disulfuro inter-catenarios y uno intra-catenarios en la cadena A que dan estabilidad a la estructura tridimensional de la molécula. El análogo de insulina Lispro difiere de la insulina humana tan sólo en dos residuos de aminoácido de la cadena B, lisina por prolina en la posición 28 y prolina por lisina en la posición 29. ( ver figura 1 ). La idea de manipular por métodos de bioingeniería esa secuencia específica de aminoácidos de la molécula de insulina humana surgió de la observación de las propiedades farmacocinéticas del IGF - 1 ( factor de crecimiento insulínico tipo 1 ). 13
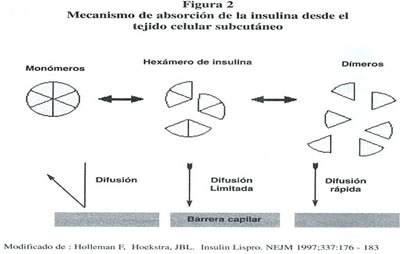
En condiciones normales cuando se administra insulina humana regular a nivel subcutáneo, ésta tiende a agregarse en forma de complejos hexámericos que retardan considerablemente el paso al lecho circulatorio de cada molécula de insulina. 9 Sin embargo, en la insulina lispro la inversión en la secuencia de estos 2 aminoácidos de la cadena B produce la eliminación de dos interacciones hidrofóbicas críticas presentes en la insulina humana regular, favoreciendo la disociación rápida de los hexámeros en monómeros de insulina Lispro. Los monómeros de insulina lispro pasan más fácilmente al torrente circulatorio, consiguiéndose de esta forma un efecto hipoglucemiante de inicio casi inmediato. 20 ( ver figura 2) Estos cambios conformacionales en la molécula de insulina no alteran de ninguna manera la unión al receptor de insulina. Se ha demostrado que la afinidad por este receptor de la insulina lispro y de la insulina humana regular es muy similar. 41
El sitio de inyección influye
también sobre la velocidad de absorción de la insulina lispro
tal como sucede con la insulina humana regular, siendo el abdomen es el
sitio de absorción más rápida y la región glútea
el sitio de absorción más lenta. 44 Estas
variaciones locales en la velocidad de absorción de la insulina,
aunque mínimas, pueden tener implicaciones terapéuticas importantes.
Existen formulaciones de insulina lispro de vida media más prolongada.
La suspensión de insulina lispro protamina ( NPL ) es una formulación
en la que la insulina lispro está cocristalizada con protamina 15
al igual que el complejo insulina humana regular/protamina (NPH). La insulina
NPL posee un perfil de actividad similar al de la insulina NPH. La combinación
del análogo lispro y de la insulina NPL ha dado lugar a la comercialización
de mezclas prefijadas de insulina lispro - NPL ( 25% y 50%). 22

La insulina Lispro empezó a
comercializarse en 1996. Para ese momento se habían realizado ya
ensayos clínicos en los que se habían incluido a más
de 3000 pacientes diabéticos.6 En la actualidad
la insulina Lispro es utilizada extensamente tanto en el tratamiento de
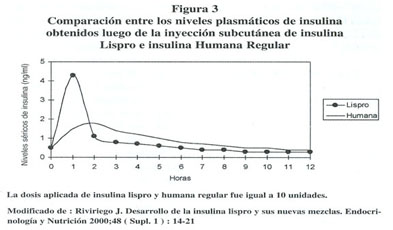
la diabetes tipo 1 como de la tipo 2. La utilidad clínica de la
Insulina Lispro reside predominantemente en el tratamiento de la hiperglucemia
postprandial, dado su rápida absorción, su inicio de acción
precoz y la corta duración de su efecto hipoglucemiante cuando se
le compara con la insulina humana regular 27 ( ver figura
3) .
En vista de estas peculiaridades farmacocinéticas, la Insulina Lispro puede administrarse inmediatamente antes de la ingesta de alimentos o bien al final de la misma si la ingesta no se prolonga excesivamente en el tiempo. Por su parte, la insulina humana regular debe aplicarse entre 30 y 60 minutos antes de la ingesta de alimentos 3, para de alguna forma minimizar el retraso que supone su lento paso a la circulación general a partir del tejido celular subcutáneo. La potencia hipoglucemiante de la insulina lispro es equivalente a la de la insulina humana regular.25
EFECTOS ADVERSOS
La insulina Lispro tiene un perfil de efectos adversos similar al de la insulina humana regular, siendo la hipoglucemia el más frecuente. Algunos ensayos clínicos han demostrado, sin embargo, que la incidencia de hipoglucemias podría disminuir hasta en un 12% con el uso de este análogo de insulina en comparación con la insulina humana regular. El máximo beneficio se ha observado en la disminución de las hipoglucemias nocturnas. 5 Como cabe esperar en base a los conocimientos farmacocinéticos, las hipoglucemias que se producen con la insulina Lispro son más frecuentes a los 90 minutos de la ingesta, mientras que con la insulina humana regular estos episodios se retardan mucho más en el tiempo. 1 La inmunogenicidad de la insulina lispro se ha estudiado con detalle. Existen al menos 4 ensayos clínicos que incluyeron en conjunto a 317 pacientes con diabetes tipo 1 y 291 pacientes con diabetes tipo 2 previamente tratados con insulina humana regular. Todos los pacientes fueron aleatorizados para recibir insulina humana regular o insulina lispro por espacio de un año. Al final del estudio se determinaron los niveles de anticuerpos anti-insulina. No se demostró diferencia estadísticamente significativa entre el nivel circulante de anticuerpos entre los pacientes que recibieron ambos tipos de insulinas. 19 En lo concerniente al perfil lipídico y al aumento de peso los ensayos clínicos realizados hasta la fecha no han evidenciado diferencias al comparar la insulina humana regular con la insulina lispro. 7 Existe aún controversia sobre la posibilidad de que la insulina lispro posea como tal algún efecto particular sobre la lipoprotein - lipasa, la lipasa hepática y la proteína transferidora de lípidos. 12 Hasta hace poco se desconocía la existencia de efectos locales de la insulina lispro sobre el volumen del tejido celular subcutáneo. Tamborlane et al 21 describieron en el 2001 dos casos de lipoatrofia en pacientes que recibían insulina lispro mediante infusión subcutánea continua. Nosotros observamos, así mismo, lipoatrofia del tejido celular subcutáneo en una paciente que recibía insulina lispro mediante el mismo procedimiento ( datos no publicados ).
APLICACIONES CLÍNICAS DE LA INSULINA LISPRO
1) En el tratamiento del niño y adolescente diabético
La diabetes en este período de edad tiene características peculiares que dificultan su control. La gran variabilidad en la ingesta y el ejercicio físico imprevisible exponen al niño a un mayor riesgo de hipoglucemias. 8 La posible administración de insulina lispro al finalizar el consumo de los alimentos puede permitir un mejor control de la hiperglucemia postprandial en los niños. Esta posibilidad ha supuesto una mejoría en el tratamiento de la diabetes infantil, ya que permite ajustar la dosis de insulina de acuerdo a lo ingerido en cada comida. Rutledge et al 40 incluyeron a 10 niños de entre 22 y 58 meses de edad en un ensayo clínico comparativo entre insulina humana regular preprandial e insulina lispro postprandial, ambas administradas a la misma dosis. Se demostró que la glucemia 2 horas después de la ingesta de alimentos era sensiblemente menor en el grupo que había recibido insulina lispro postprandial.
También en el adolescente puede producirse una considerable impredecibilidad en el horario de ingestión de los alimentos. De la misma manera, la actividad física, el estado emocional y hormonal varían constantemente. Estos factores explican en buena parte la dificultad del control metabólico en los adolescentes diabéticos. Holcombe et al 24 realizaron un estudio comparativo en un grupo de casi 500 adolescentes con diabetes tipo 1 demostrando una disminución significativa en el número de episodios de hipoglucemia nocturna en el grupo de pacientes que utilizó insulina lispro en comparación con los que fueron tratados con insulina humana regular. Del mismo modo, en otro estudio que utilizó dosis nocturnas similares de insulina lispro e insulina humana regular se demostró que la incidencia de hipoglucemias nocturnas fue menor en el grupo tratado con insulina lispro. 34 No existen publicaciones, hasta la fecha, sobre el uso de insulina lispro en niños menores de un año.
2) Durante el embarazo
Se ha demostrado que la glucemia una hora después de la ingesta de alimentos se correlaciona con el tamaño fetal y el riesgo de morbi-mortalidad materno-infantil. 14 A pesar de las ventajas potenciales que el uso de la insulina lispro podría tener en el tratamiento de la hiperglucemia postprandial en el embarazo, su uso durante la gestación todavía no ha sido aprobado, ya que los estudios realizados hasta el momento son insuficientes para avalar su inocuidad. 11 Existen algunos reportes aislados que sugieren que este análogo de la insulina podría tener efectos embriotóxicos cuando se emplea durante las primeras semanas de la gestación. Diamond et al publicaron dos casos de pacientes tratadas con insulina lispro en el período de organogénesis, en el primer caso la gestación se interrumpió a la semana 20 al confirmarse por medio de amniocentesis una embriopatía grave ( la autopsia del producto demostró malformaciones cardiovasculares severas ), en el segundo caso se produjo la muerte perinatal debido a una hernia diafragmática gigante.17 Otros trabajos recientes han informado que el tratamiento con insulina lispro durante el embarazo puede acompañarse de un empeoramiento en las alteraciones microvasculares de la retina. 31 Se ha sugerido que la insulina lispro podría actuar como factor de crecimiento a nivel de la microcirculación de la retina en el embarazo, dado que su mayor afinidad por el receptor del IGF-1 es 1,5 veces superior a la insulina humana regular. Sin embargo, Jovanovic et al 28-29 sugieren que en el tratamiento de la diabetes gestacional la insulina lispro presenta ventajas significativas sobre la insulina humana regular. Incluso en uno de estos trabajos se exploró mediante cordocentesis la presencia de insulina lispro en sangre del cordón umbilical, no detectándose concentración alguna del análogo. En ninguno de los grupos se observaron anormalidades fetales o neonatales.
3) En el tratamiento con infusión subcutánea continua de insulina
La insulina lispro presenta algunas ventajas farmacocinéticas respecto a la insulina humana regular cuando se utiliza en la terapia con bombas de infusión de insulina. 4 En 1998 Zinman et al 46 publicaron los datos de un estudio doble ciego y cruzado donde compararon la insulina humana regular con la insulina lispro en pacientes que utilizaban bomba de infusión de insulina. La hemoglobina glicosilada fue significativamente más baja ( 0,4% ) durante el tratamiento con insulina lispro. En otro estudio aleatorizado, cruzado y multicéntrico con 113 pacientes se halló que los valores de glucemia en la primera y segunda hora postprandiales eran más bajos con insulina lispro. Así mismo, los pacientes que recibieron como terapia el análogo de insulina presentaron una menor variabilidad de la glucemia durante el día. 38 Además, el uso de este análogo de insulina se asocia a una disminución de los episodios de hipoglucemia en pacientes que siguen este tipo de terapia. 33 Aunque se ha sugerido que la insulina lispro podría ser la insulina ideal para los pacientes que utilizan terapia con bomba de insulina, existe evidencia de que en los sujetos con falta de reconocimiento de las hipoglucemias, la insulina lispro puede producir un aumento en el número de episodios de hipoglucemia y un empeoramiento del control metabólico. 35
4) En el tratamiento de los síndromes de insulin - resistencia extrema
En pacientes diabéticos donde se requiera más de 2 unidades / kilo / día de insulina para optimizar el control metabólico, debe explorarse la coexistencia de alteraciones inmunológicas específicas que alteren la acción de la insulina.18 Algunos reportes sugieren que la insulina lispro podría constituir una alternativa terapéutica viable en el tratamiento de los síndromes de insulina-resistencia extrema causados por anticuerpos anti-insulina.32 Se desconoce el mecanismo que genera la producción de estos auto-anticuerpos en pacientes que han sido tratados previamente por largos períodos con insulina humana regular. Tampoco se conoce con certeza la razón por la cual la insulina lispro mejora el control metabólico en estos pacientes. La resistencia subcutánea a la insulina es una complicación rara en el paciente diabético, pero ante su presencia las opciones terapéuticas son escasas. Henrichs et al reportaron en 1996 23 la eficacia de la insulina lispro ( 1,5 u/kg ) para normalizar los niveles de glucemia en una paciente que recibía 235 unidades (3 u/kg) de insulina humana regular endovenosa por día debido a la incapacidad de las inyecciones subcutáneas de esta insulina para evitar la cetogénesis. En nuestra unidad se logró la normalización de la glucemia administrando insulina lispro diluida al 50% con heparina sódica al 1 % mediante infusión subcutánea continua en una paciente diabética de 91 años de edad con un síndrome severo de resistencia subcutánea a la insulina y títulos altos de anticuerpos anti-insulina luego de terapia fallida con plasmaféresis e inmunosupresión. (datos no publicados)
5) En el abordaje de las hiperglucemias incidentales
Ocasionalmente, los pacientes que se realizan auto análisis de glucemia frecuentes utilizando reflectómetros personales detectan hiperglucemias incidentales entre comidas. Se considera que la trasgresión dietética, la inactividad física o la dosificación incorrecta de insulina son los principales factores etiopatogénicos de este fenómeno, aunque en algunos casos no se logra identificar una causa específica. La administración de insulina lispro ha demostrado ser una buena opción para el tratamiento de las hiperglucemias incidentales. 26
6) En la terapia insulínica endovenosa
El abordaje terapéutico inicial de la cetoacidosis diabética debe realizarse preferiblemente con insulina endovenosa. 30 Aunque diversos estudios han demostrado la efectividad de la insulina lispro endovenosa 43, no se ha logrado demostrar diferencia alguna con respecto a la insulina humana reguIar en lo concerniente a eficacia y efectos colaterales.
LIMITACIONES DEL USO DE INSULINA LISPRO
Hasta la fecha carecemos de ensayos clínicos que hayan demostrado que la insulina lispro sea superior a la insulina humana regular respecto al control de la glucemia a largo plazo. Existen algunos trabajos que han dejado patente una mejoría de la hemoglobina glicosilada al utilizar insulina lispro como parte de la terapia insulínica, pero sólo cuando además al mismo tiempo se pautó insulina NPH varias veces al día (2-3) para asegurar un reemplazo óptimo de insulina basal. 16 La necesidad de administrar la insulina humana regular 30 minutos antes de la ingesta alimentaria en contraposición a la administración preprandial inmediata de la insulina lispro ha dificultado considerablemente la realización de estudios a doble ciego, situación que indudablemente resta credibilidad a los ensayos clínicos publicados hasta ahora.
COMPARACIÓN CON OTROS ANÁLOGOS DE LA INSULINA
La insulina aspart es otro análogo de la insulina de acción rápida comercializado más recientemente. Existen hasta la fecha pocos estudios comparativos entre la insulina lispro y la aspart. Los primeros reportes sugieren que su eficacia clínica es similar tanto cuando se compara su uso en terapia insulínica intensificada como en infusión subcutánea continua. Bode et al 10 compararon en forma prospectiva el uso de insulina lispro, aspart y humana regular en pacientes tratados mediante infusión subcutánea continua. Al cabo de 16 semanas de tratamiento, las medias de hemoglobina glicosilada de los 146 diabéticos tipo 1 enrolados en los tres tipos de terapia no presentaron diferencias estadísticamente significativas al ser comparadas entre si.
CONSIDERACIONES FINALES
La importancia pronóstica de la hiperglucemia postprandial como factor de riesgo para el desarrollar posterior de complicaciones micro y macrovasculares está aún por definirse. Ante la creciente aparición de análogos de insulina y secretagogos de acción corta ( meglitinidas ) cuyo principal acción es prevenir las excursiones glucémicas postprandiales, la ADA (American Diabetes Association) comunicó recientemente 2 la ausencia de evidencia sólida a favor de un posible rol de la hiperglucemia postprandial en la etiopatogenia de las complicaciones crónicas de la diabetes mellitus. A pesar de que la insulina lispro cuenta con indicaciones clínicas específicas, ante la evidencia de que disponemos en la actualidad, las ventajas de su uso sobre la insulina humana regular parecen limitarse a la comodidad que supone la posibilidad del administración preprandial inmediata y a la mejoría del control metabólico observado en pacientes tratados mediante infusión subcutánea continua.
RESUMEN
La insulina lispro es un análogo de insulina regular cuya principal indicación reside en el control de las excursiones glucémicas postprandiales. Se cuenta ya con experiencia clínica suficiente como para garantizar su eficacia y seguridad en la terapia insulínica del diabético tipo 1 y 2. A pesar de sus particularidades farmacocinéticas y aplicaciones clínicas específicas, no ha sido posible demostrar que sea más eficaz que la insulina humana regular para mejorar el control metabólico del paciente diabético.
BIBLIOGRAFÍA
1) Acosta D, González D. Efectos del tratamiento con insulina Lispro sobre hipoglucemias leves y graves. Endocrinología y Nutrición 2001;28 ( Supl.1 ): 34-38
2) American Diabetes Association. Postprandial blood glucose. Diabetes Care 2001;24:775-778
3) American Diabetes Association. Standards of medical care for patients with diabetes mellitus. Diabetes Care 1995; 18 (Supl. 1 ): 8-15
4) Ampudia-Blasco JF Optimización del tratamiento insulínico en la diabetes. Perspectivas actuales de la infusión subcutánea de insulina. Ediciones DOYMA, S.L. Barcelona, España. 2000
5) Anderson JH, Brunelle RL, Koivisto VA, Pfutzner A, Trautmann ME et al. Reduction of postprandial hyperglicemia and frequency of hypoglicemia in IDDM patients on insulinanalog treatment. Diabetes 1997;46:265-270
6) Anderson JH, Koivisto VA. Estudios clínicos con Insulina Lispro. Drugs of Today 1998;34 ( Supl. 6 ):35-48
7) Anderson JH, Koivisto VA. Estudios clínicos con insulina lispro. Drugs of today 1998;34 ( Supl. 6 ) : 35-48
8) Barrio R. Utilización de insulina lispro en situaciones especiales. II. Niños y adolescentes. Endocrinología y Nutrición 2001;48 ( Supl.1 ): 48-53
9) Binder C. A theoretical model for the absorption of soluble insulin. En : Brunetti P, Alberti KGMM, Albisser AM, Hepp KD, Benedetti MM, eds. Artificial systems for insulin delivery. Vol. 6. New York: Raven Press,1983:53-57
10) Bode B, Weinstein D, Bell D et al. Comparison of insulin aspart with buffered regular insulin and insulin lispro in continuous subcutaneous insulin infusion : a randomized study in type 1 diabetes. Diabetes Care 2002;25:439-444
11) Caballero A, Levy I. Utilización de insulina lispro en situaciones especiales. III. Gestación. Endocrinología y Nutrición 2001;48 (Supl.1 ): 54-57
12) Caixás A, Pérez A. Tratamiento con insulina lispro y perfil lipídico. . Endocrinología y Nutrición 2001;48 (Supl.1 ): 29-33
13) Chance RE, Frank BH, Radziuk JM, Di Marchi RD. Descubrimiento y desarrollo de la insulina lispro. Drugs of Today 1998;34: 19
14) de Veciana M, Major CA, Morgan MA, Asrat T, Toohey JS, Lien JM, Evans AT: Postprandial versus preprandial blood glucosa monitoring in women with gestational diabetes mellitus requiring insulin therapy. N Engl J Med 1995;333:1237-1241
15) DeFelippis MR, Bakaysa DL, Bell MA, Heady MA et al. Preparation and characterization of a cocrystaline suspensión of Lys B28 - Pro B 29 human insulin analogue. J Pharm Sci. 1998;87:170-176
16) Del Sindaco P, Ciofetta M, Lalli C, et al. U se of the short -acting insulin analogue lispro in intensive treatment of type 1 diabetes mellitus: importance of appropriate replacement of basal insulin and time-interval injectionmeal. Diabet Med 1998; 15: 592-600.
17) Diamond T, Kormas N. Possible adverse fetal effect of lispro insulin. N Engl J Med 1997;337:1009-1010
18) Federlin KF. Immunology of Insulins. En : Berger M, Gries A ( eds ). Frontiers in Insulin Pharmacology. Georg Thieme Verlag, Stuttgart, 1993
19) Fineberg NS, Fineberg SE, Anderson JH, Binkett MA, Gibson RG, Hufferd S. Immunologic effects of insulin lispro in IDDM and NIDDM patients previosly treated with insulin. Diabetes 1996;45:1750-1754
20) Frank BH, Baker JC, Bakaysa DL, Brader ML et al. Lys B28 - Pro B29 - Human insulin ( Insulin Lispro ): solution properties of a rapid-acting insulin. Diabetología 1995;38 ( Suppl.l ): A189
21) Griffin ME, Feder A, Tamborlana WV. Lipoatrophy associated with lispro insulin in in sulin pump therapy. Diabetes Care 2001;24:174
22) Heise T, Weyer C, Serwas A et al. Timeaction profiles of novel premixed preparations of insulin lispro and NPL insulin. Diabetes Care 1998;21:800-803
23) Henrichs HR, Unger H, Trautmann ME, Pfützner A. Severe insulin resistente treated with insulin lispro. Lancet 1996;348:1248
24) Holcombe J, Zalani S, Arora V, Headlee S, Gill A. Insulin lispro results in less nocturnal hypoglycemia compared with regular human insulin in adolescents with type 1 diabetes. Diabetes 1997;46( Supl. 1 ):402A
25) Holleman F, Hoekstra, JBL. Insulin Lispro. NEJM 1997;337:176 - 183
26) Holleman F, van der Brand JJG, Hoven RARA et al. Comparision of LysB28-ProB29 human insulin analog and regular insulin in the correction of incidental hiperglicemia. Diabetes Care 1996;19:1426-142
27) Howey DC, Bowsher RR, Brunelle RL, Woodworth JR. Lys ( B28 ), Pro (B29) - human insulin: a rapidly-absorbed analogue of human insulin. Diabetes 1994;43:396-402
28) Jovanovic L, Illic S, Pettitt D et al Metabolic and inmunogenic effects of insulin lispro in gestacional diabetes. Diabetes Care 1999;22:1422-1427
29) Jovanovic L, Illic S, Pettitt D et al. Insulin lispro and regular insulin : postprandial glucosa and insulin in gestacional diabetes. Diabetología 1998:41 ( Supl.1 ): A48
30) Kitabchi AE, Umpierrez GE , Murphy MB, Barrett EJ et al. Management of hyperglycemic crises in patients with diabetes. Diabetes Care 2001; 24:134-153
31) Kitzmillier J, Main E, Ward B, et al. Insulin lispro and the development of proliferative diabetic retinopathy during pregnancy. Diabetes Care 1999; 22:874-875
32) Lahtela JT, Kinp M, Paul R, Antonen J, Salmi J. Severe antibody-mediated insulin resistente : succesful treatment with the insulin analog lispro. Diabetes Care 1997;20:71-73
33) MeIki V, Renard E, Lassmann V, Boivin S et al. Improvement of HbA1c and blood glucose stability in IDDM patients treated with lispro insulin analog in external pumps. Diabetes Care 1998;21:977-982
34) Mohn A, Matyka KA, Harris DA, Ross KM, Edge JA, Dunger DE. Lispro or regular insulin for multiple injection therapy in adolescence. Diabetes Care 1999;22:27-32
35) Ooi C, Mullen P, Williams G. Insulin lispro. The ideal pump insulin for patients with severe hipoglycemic unawareness. Diabetes Care 1999;22: 1598-1599
36) Owens DR, Zinman B, Bolli GB. Insulins today and beyond. Lancet 2001;358:739-46
37) Pallardo LE Hiperglucemia postprandial y complicaciones crónicas de la diabetes mellitus. Endocrinología y Nutrición 2001;48 (Supl. 1 ):2-13
38) Renner R, Pfutzner A, Trautmann M et al. Use of insulin lispro in continuous subcutaneous insulin infusion. Diabetes Care 1999;22:784-788
39) Rhodes CJ, White ME Molecular insights into insulin action and secretion. Eur J Clin Invest. 2002;32( Supl. 3):3 -13
40) Rutledge KS, Chase HP, Klingensmith GJ et al. Effectiveness of postprandial humalog in toddlers with diabetes. Pediatrics 1997; 100:968-972
41) Slieker U, Sundell K. Modifications in the 28-29 position of the insulin B-chain alter binding to the IGF-1 receptor with minimal effect on insulin receptor binding. Diabetes 1991;40 (Supl.1):168A
42) Soria B. Transplante de islotes y de células diferenciadas a partir de células madre. Av Diabetol 2001;17:121-128
43) Stiller R, Kothny T, Schwabing K et al. Administración intravenosa de insulina lispro frente a insulina regular en pacientes con diabetes tipo 1. 59th Annual Scientific Sessions on the American Diabetes Association, 2000
44) ter Braak EW, Bianchi R, Erkelens DW. Faster, shorter and more profound action of LysB28-ProB29 human insulin analogue compared to regular insulin irrespective of injection site. Diabetes 1993;42 ( Supl. 1): 207A
45) The Diabetes Control and Complications Trial Research Group. The effect of intensive insulin therapy on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-86
46) Zinman B, Tildesley
H, Chiasson JL, Tsui E, Strack T. Insulin lispro in CSII: results of a
double-blind crossover study. Diabetes 1997; 46: 440-43