ENFERMEDADES PARASITARIAS
ESQUISTOSOMIASIS MANSONI
Una Perspectiva Brasileña
(Segunda Parte)
Rodrigo Siqueira-Batista*, Andréia Patrícia Gomes**, William Fernando Cevallos Trujillo***,
Sávio Silva
Santos****, Donald William Huggins*****
Summary
Schistosomias
is mansoni is one the most important infectious disease of the actuality.
lt has emerged and reemerged in some arcas around the world. This
paper reviews the aspects of disease in Brazil, where it's a health public
problem.
Key words: Schistosomiasis
mansoni; Review; Brazil; Parasitic diseases.
Nefropatía esquistosomótica
El acometimiento
renal en la esquistosomiasis mansoni es más frecuente en la forma
hepatoesplénica de la enfermedad. Aproximadamente 12 a 15%
de las personas infectadas por el S. mansoni y que presentan esta forma,
desenvuelven a nefropatía esquistoso mítica, que acomete ambos
sexos, con mayores prevalencias, en la mayoría de las veces, en adultos
jóvenes en la tercera década de vida, siendo la expresión
clínica más importante de la enfermedad, el síndrome
nefrótico.
Podemos clasificar la nefropatía
esquistosomiática en:
(1) incipiente
(fase l), en la cual las alteraciones se presentan apenas a la luz
de la microscopía electrónica;
(2) proliferación
mesengial (fase II), sin evidencia clínica y de laboratorio, si embargo
ya visualisable a través de la microscopía óptica;
(3) síndrome
edemagénico (fase III), con alteraciones de laboratorio como proteinuria,
cilindruria y hematuria, sin embargo raramente con piuria;
(4) síndrome
nefrótico (fase IV), frecuentemente acompañada por grados
variables de insuficiencia renal.
El mecanismo
fisiopatogénico es distinto. En cuanto a las otras formas
clínicas de la esquistosomiasis, la formación de granuloma
en torno de los huevos sería el evento más importante, en
la nefropatía, la reacción inmunológica mediada por
la formación de inmunocomplejos depositados en los glomérulos,
representa el provable mecanismo patogénico.
Formas ectópicas
Son consideradas
como aquellas en las cuales la presencia del elemento parasitario - huevos
o vermes adultos - se localizarían fuera del sistema porto cava,
el habitat natural del helminto. Tiene importancia la neuroesquistosomiasis,
pudiendo entre tanto haber otras localizaciones para el helminto.
Neuroesquistosomiasis
- Acreditase en la existencia de tres mecanismos por los cuales, los huevos
del S. mansoni se localizan en el sistema nervioso central (Malta, 1994):
(1) embolización
de huevos a través de la red arterial, decorrente de la presencia
de anastomosis arterio-venosas previas;
(2) migración de
huevos a través de anastomosis entre los sistemas venosos portal
y de Batson;
(3) oviposición in
situ, después de la migración anómala de los helmintos.
A pesar de
la presencia de huevos puede ser importante para el desencadenamiento de
anormalidades neurológicas, no siempre estas ocorrirán - hay
relatos de necropsias de pacientes previamente asintomáticos, que
tenían huevos en su sistema nervioso central. Además
de eso, vermes adultos pueden ser igualmente encontrados. El cuadro
clínico dependerá, obviamente, de la localización de
los huevos o vermes. Más frecuentemente encontramos síntomas
neurológicos comprometiendo la médula espinal a nivel lumbar,
con cuadro de mielitis transversa. En terminos de diagnóstico
diferencial, se hace importante la exclusión de otras causas, como
por ejemplo neoplasias, para la enfermedad neurológica.
Otras
Localizaciones - Son bastante raras y clínicamente no sospechadas,
siendo su diagnóstico, generalmente, encontrado de la biopsia o necropsia.
La mayoría de los casos son de exiguo interes clínico, con
excepción de la neuroesquistosomiasis, la cual se reviste de gran
importancia médica. Ejemplos otros de ectopía en la esquistosomiasis
mansoni incluyen la apendicular, vesicular, pancreática, peritoneal,
genito-urinaria, miocardio, cutánea, esofágica, gástrica,
tireoidea y suprarrenal.
Esquistosomosis
y AIDS
No se tienen
muchos relatos en relación a la asociación entre esquistosomiasis
y en infección por el virus de la inmunodeficiencia humana (HIV).
Algunos estudios parecen demonstrar la existencia de una reacción
inmunológica cruzada entre un factor infeccioso del virus de HIV-1
(vif) y un antígeno de superficie del S. mansoni. Así,
la esquistosomiasis determinaría también una alteración
sensible de la función inmunitaria que podría interferir en
la propensión del esquistosomiático al HIV y viceversa.
En aquellos pacientes, simultaneamente infectados por el HIV y parasitados
por S. mansoni, la formación de granulomas es rara. Entre tanto,
una reacción inmunológica peri-huevo es observada en aquellos
pacientes con AIDS en fase terminal y en aquellos pacientes portadores del
HIV- 1 y que estan infectados por el S. mansoni.
Diagnóstico
Delante de
la sospecha clínica de esquistosomiasis mansoni, basada en datos
clínicos y epidemiológicos, está indicada la realización
de la evaliación de laboratorio diagnóstico. Métodos
parasitológicos e inmunológicos pueden ser empleados.
Métodos
parasitológicos
En el diagnóstico
parasitológico es fundamental el examen de heces, con especial importancia
para las técnicas de Lutz y Kato-Katz esta última es una técnica
cuantitativa, con grande aplicabilidad en la inferencia de la carga parasitaria.
Detecta la presencia de huevos en las heces, lo que ocurre después
del 45° día de infección. Hay importantes variaciones
en la positividad del examen de heces, en la dependencia de factores tales
como carga parasitaria, experiencia del laboratorista y tiempo de infección
(cuanto más antigua la infección, en general, menor es la
oviposición. La biopsia rectal, técnica indolora y de
rápida ejecución, es también útil, siendo de
mayor positividad que el parasitológico de heces. Es muy importante
en el control de la cura, pudiendo ser sistemáticamente adoptada con
esta finalidad. El raspado rectal tambiém es empleado, sin,
entre tanto, presentar ventajas sobre la biópsia rectal. Las
biopsias de tejido (intestino, hígado) también ofrecen el diagnóstico
en la evaluación histopatológica, representando, sin embargo,
más hallazgos que los métodos diagnósticos propriamente
dichos.
Pruebas
inmunológicas
Las reacciones
inmunológicas son más empleadas en la fase crónica
de la enfermedad (son positivas a partir del 25° día).
Su importancia aumenta con la progresión (crónica) de la enfermedad.
La principal son intradermoreacción (apropiada para investigaciones
epidemiológicas y para el diagnóstico de los pacientes no
oriundos de área endémica, con cuadro sugestivo de estar presentando
alteraciones relacionadas a la fase prepostural), reacciones de fijación
del complemento, inmunofluorescencia indirecta, técnica inmunoenzimática
(Enzyme linked immunosorbent assay) - ELISA) y ELISA de captura. Otros
exámenes como el test de aglutinación cercariana, reacciones
circunovular o periovular (reacción de Oliver-González), pericercariana
(reacción cercariana de Vogel y Minning), de inmobilización
del miracidio, radioinmunoensayo y hemaglutinación indirecta son
poco usuales.
Evaluación inespecífica
En el hemograma,
encontramos eventualmente, leucopenia y eosinofilia discreta a moderada
y plaquetopenia. La anemia hemolítica (hiperesplenismo) es
poco común. Hay hipoalbuminemia leve en la forma compensada
e intensa en la descompensada, con acentuada elevación de la gammaglobulinemia
(en la fase crónica de la parasitosis se verifica tasa elevada de
IgG). Las pruebas de función hepática, en al fase compensada
de la forma hepatoesplénica, las reacciones que prueban la función
del hígado son normales, excepto fosfatasa alcalina y g-GT que se
encuentran aumentadas. Ya en la fase descompensada, verificamos discretas
elevaciones de las transaminasas (100-200 UI), bilirrubinas (2 a 5mg%) y
tiempo de actividad de protrombina. Las pruebas de función renal,
como dosificación de urea y creatinina se encuentran, en general,
dentro de los valores de referencia, salvo en los casos de nefropatía
esquistosomiática avanzada.
Métodos
complementarios
Algunos
métodos deben ser empleados para la satisfactoria evaluación
de los esquistosomiáticos en las diferentes formas clínicas.
Así, tienen importancia la teleradiografía de tórax
(evaluación de la forma vásculo-pulmonar), el ecocardiograma
(evaluación de la forma vásculo-pulmonar), la ultrasonografia
abdominal (evaluación de la forma hepatoesplénica), endoscopía
digestiva alta y baja (evaluación da forma hepatoesplénica)
y la esplenoportografía (evaluación de la forma hepatoesplénica),
esta última en desuso después del advenimiento de la ultrasonografía
con dopplerflujografia.
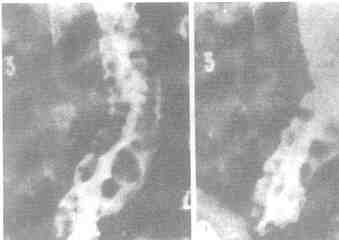 Figura 3. Radiografía
contrastada de esófago mostrando la presencia
de varices voluminosas
(Fotografía del Prof. Donald William Huggins).
Figura 3. Radiografía
contrastada de esófago mostrando la presencia
de varices voluminosas
(Fotografía del Prof. Donald William Huggins).
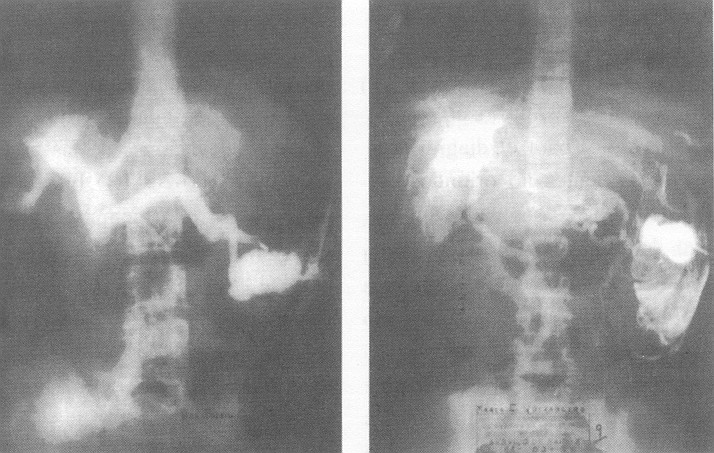 Figura 4. Esplenoportografía
mostrando las venas porta y esplénica con los calibres significativamente
aumentados
(a) y la recanalización
de la vena umbilical (b) (Fotografía del Prof. Donald William
Huggins).
Figura 4. Esplenoportografía
mostrando las venas porta y esplénica con los calibres significativamente
aumentados
(a) y la recanalización
de la vena umbilical (b) (Fotografía del Prof. Donald William
Huggins).
Tratamiento
Del tratamiento
específico, particularidades deben ser consideradas para la terapéutica
dos diferentes estadios evolutivos de esquistosomiasis mansoni. La
fase aguda, a dermatite cercariana y tratada con anti-histamínicos
locales y corticosteroides tópicos, asociados al tratamiento con
los fármacos específicos. Los cuadros de fiebre toxémica
pueden requerir internación hospitalaria, debiéndose indicar
reposo, hidratación adecuada, uso de antitérmicos, analgésicos
y antiespasmódicos. En la fase crónica, en las formas
intestinal, hepatointestinal y hepatoesplénica, deben ser
comtempladas medidas para aminorar el cuadro diarreico (cuando presente)
y los fenómenos dispépticos. En la forma hepatoesplénica,
conductas para reducción del riesgo de hemorragias digestivas, como
la escleroterapia de varices de esófago y el uso de B-bloqueadores,
también son extremamente relevantes. El tratamiento específico
es realizado con los fármacos: praziquantel y oxaminiquine.
El praziquantel es un derivado del núcleo isoquinoleínico-pirazínico,
actuando en la permeabilidad del calcio en las células del helminto,
habiendo aumento de la concentración de ese ión con vacuolozación
y destrucción tegumentaria. Actua contra las tres especies
del género Schistosoma que parasitan el hombre (Quintas et al, 1993),
actuando también sobre Taenia solium, Taenla saginata, Hymeno-lepis
nana (inclusive las formas larvarlas), Diphyllobothrium latum, Opisthorchis
viverrini, Paragominus westermani, Dipylidium caninum, Fasciolopsis buski,
Heterophytes heterophytes, Metagonimus yokogawal, Nanophyetus salmincola
y Clonorchis sinensis. El uso contra la Fasciola hepática encuentrase
en estudios. La dosis utilizada es de 40 mg/kg, en toma única,
habiendo 80-90% de cura. Las reacciones adversas incluyen náuseas,
dolores abdominales, cefalea, conducta anormal, somnolencia, palpitación,
prurito, urticaria, vómito, cinestosis, diarrea, hipoacusia, hiporreflexia,
disturbio visual y tremor. Estos síntomas y signos generalmente
duran de 24 a 48 horas, desapareciendo espontáneamente. A pesar
de pesquisas recientes no tiene demonstrado mutagenicidad o teratogenicidad,
el fármaco no debe ser entregado a gestantes. Es excretado
por la leche materna, siendo recomendado que las mujeres no amamanten el día
en que el praziquantel va a ser administrado y durante las 72 horas subsecuentes.
Es contraindicado en la insuficiencia hepática, renal y cardíaca
graves, bien como en la forma hepatointestinal descompensada.
Oxaminiquine
es un derivado tetrahidroguinólico, con actividad estricta sobre
el S. mansoni, actuando en todos sus estadios evolutivos (Quintas et al,
1993). El mecanismo de acción por el cual es poco conocido
(aparentemente se liga al material genético del parásito).
La dosis es de 15 mg/kg en toma única para los adultos y de 20 mg/kg
en toma única para niños. Los efectos colaterales más
comunes atribuidos a la droga son tonteras, somnolencia, cefalea, manifestaciones
neuropsíquicas (excitación, irritabilidad, convulsión,
alucinaciones, etc.). También pueden ocurrir fiebre, hipertensión
arterial, leuco y linfopenia transitorias. Para aliviar tales sintomas,
recomiéndase administrarla después de las comidas (café
matinal o merienda). Es contraindicado en embarazadas, en las lactantes,
en niños con menos de dos años de edad, en las insuficiencias
renal, hepática y cardíaca descompensadas, y en casos de hipertensión
porta descompensada. Además de eso, no debe ser utilizado en
personas con epilepsia. Para el acompañamiento de cura son realizados
seis exámenes parasitológicos de heces (1 por mes o dos a
cada dos meses) y/o una biopsia rectal en el sexto mes despues del tratamiento
(la cual debe ser, de preferencia, siempre realizada). La resistencia
a los fármacos es descrita en la literatura. Entre tanto, en
Brasil, no se ha constituido un problema. Hay relato de una cepa resistente
al oxamniquine, sin descrpción de resistencia al praziquantel.
El tratamiento quirúrgico es realizado por diferentes técnicas,
principalmente la esplenectomía (para la hipertensión porta
con hiperesplenismo), anastomosis porto-cava (esta última en desuso
por la mayor ocurrencia de encefalopatía hepática), anastomosis
esplenorrenal y técnicas de reparación de las várices
esofágicas. El transplante hepático viene siendo utilizado
con buenos resultados, a pesar de las dificuldades técnicas, relacionadas
a la dificuldad de donadores, inherentes al procedimento.
Epidemiología
y control
La esquistosomiasis
se encuentra distribuida en varias regiones tropicales del mundo y es observada
en más de 50 países - continentes americano y africano -,
siendo estimada una prevalencia mundial de 200 millones- de individuos.
Los principales países latinoamericanos nombrados son Brasil, Venezuela,
Puerto Rico, Antillas y Suriname.
Características
epidemiológicas
Estimatibas
apuntan a 12 millones de individuos acometidos por la enfermedad en Brasil,
correspondiendo a aproximadamente 1% de la población brasileña,
la mayoría de estes localizada en los estados del nordeste.
Los principales estados acometidos son Alagoas, Sergipe, Bahia, Minas Gerais
y Pernambuco. Los estados de Río de Janeiro, San Paulo, Espírito
Santo, Paraná, Pará, Maranháo, Piauí, Paraíba,
Ceará e Río Grande del Norte también poseen una grande
incidencia, pero en menor escala que los anteriormente mencionados.
En los estados no citados, la incidencia es baja y con focos bastante dispersos.
La enfermedad parece estar en expansión, no solo en virtud de la
migración nordestina para los estados del sur y sudeste del país,
pero también por receptividad ecológica (presencia del planorbídeo),
condiciones precarias de saneamiento y bajo nivel socio-económico.
Son considerados factores importantes para que a enfermedad se torne endémica:
- la presencia de una
persona susceptible;
- ocurrencia del huésped
intermediario (planorbídeo);
- gran distribución
y alta resistencia del huésped intermediario (molusco) a los periodos
de sequía.
- existencia de colecciones
de agua adecuados al desenvolvimiento del huésped intermediario, en
los cuales la población tenga el hábito de bañarse,
lavar sus ropas y utensilios domésticos;
- desagües de agua
servidas de los domicilios en las colecciones de agua o próximo
a éllas;
El S. mansoni
puede infectar, en condiciones de laboratorio, primates, roedores, marsupiales,
carnívoros silvestres y ruminantes. Pero, no existen evidencias
concretas de la importancia epidemiológica de estos reservatorios,
siendo el hombre considerado el único a contribuir para el cielo
epidemiológico. Entre tanto, más recientemente, especies
de ratas de agua (género Nectomys), viene siendo apuntados como reservatorios
en el municipio de Sumidouro, en Río de Janciro. Los huéspedes
intermediarios de S. mansoni son invertebrados del filo Mollusca clase Gastropoda,
orden Pulmonata, familia Planorbidae, subfamilia Planorbinae, género
Biomphalaria. La especie más importante por su distribución
y por sus caracteristicas biológicas favorables al desenvolvimiento
del helminto, es la Biomphalaria glabrata. Biomphalaria tenagophila
y Biomphalaria straminea son tambiém importantes, siendo la primera
especie encontrada principalmente en el sur del país, estado de San
Paulo y Sur de Bahía y la segunda, encontrada en casi todas las cuencas
hidrográficas del país. La Biomphalaria tenagophila posee
tasa de infección natural por el S. mansoni muy baja. En condiciones
de laboratorio, otras dos especies, Biomphalaria peregrina y Biomphalaria
amazonica, son suceptibles a la infección. Para que los individuos
sean infectados, es necesario que haya contacto con colecciones de aguas
contaminadas. Esto ocurre principalmente donde no hay abastecimiento
público de agua potable y saneamiento, hecho que obliga a la población
a utilizar de ríos, lagos, pequeñas represas, entre otros,
para la realización de sus actividades rutinarias, como bañarse,
lavar ropas y utensilios de cocina y hasta utilizar estas aguas para consumo,
sin cualquier tratamiento previo. Los mayores focos ocurren en las
áreas de irrigación y en colecciones de agua peridomiciliares,
polulados por heces humanas y ricas en materia orgánica, favoreciendo,
así, un ambiente propicio al caracol. Los focos endémicos
ocurren en mayor cantidad en las áreas rurales y constituyen un problema
grave en comunidades de baja renta en las periferias de las grandes ciudades,
principalmente en localidades donde no hay saneamiento básico y donde
los desechos son lanzados directamente en canales que irán a desembocar
en ríos y lagos. Los moluscos eliminan las cercarias principalmente
entre once y trece horas, horario en que el sol está más caliente
y la frecuencia de baños en estos ambientes se intensifica.
Antes de las nueve horas (inicio de la eliminación), el riesgo de
contaminación es muy bajo y a partir de las once horas (pico de la
eliminación), el riesgo es extremamente alto. El período
del año de mayor índice de transmisión es el verano.
En regiones de estación lluviosa y seca bien definidas, este período
ocurre en el inicio del estiagen. En aguas estancadas, la contaminación
se da bien próxima a las colonias de moluscos, en cuanto en ríos,
esta contaminación puede ocurrir hasta cerca de cien metros de estas
colonias, debido a las corrientes. En general, el grupo etario con
mayores tasas de infección está comprendida entre 15 y 20
años, pues estos individuos van acumulando continuas infecciones
desde los dos años de edad, período en que también
hay una mayor eliminación de huevos en las heces. La carga parasitaria
tiende a bajar a partir de los veinte años, debido al envejecimiento
y muerte natural de los parásitos. Este hecho puede ser atribuido
tambiém al aumento de la resistencia de los individuos en el recorrer
de estas reinfecciones.
 Figura 5. Colección
de agua en la cual fue encontrada gran cantidad de cercarías
(Fotografía del
Prof. Donald William Huggins).
Figura 5. Colección
de agua en la cual fue encontrada gran cantidad de cercarías
(Fotografía del
Prof. Donald William Huggins).
Control
El control
de la esquistosomiasis en el país depende, principalmente, de voluntad
política de la clase dirigente, lo que es, por si solo, muy dificil
en un país donde, históricamente, se acostumbro a relegar
las migajas a los menos favorecidos (Siqueira-Batista, 1996). Es importante
recordar que la evolución de la enfermedad no es generada apenas
por la pobreza e ignorancia de la población, pero, también,
por el progreso, desenfrenado y desorganizado. Se hace necesario que
los médicos comprendan que el tratamiento completo de esta parasitosis
incluye la explicación del modo de infección bien como las
medidas preventivas de la reinfección que estén a su alcance.
Se a de tener en mente sin jamás olvidarlo - que el estado de privación
cultural en el cual vive gran parte de la población pobre no deberá
ser confundida con deficiencia intelectual. Es en este contexto que
programas de control de la enfermedad deben ser desarrollados considerándose:
- quimioterapia efectiva,
en masa o individual;
- control del huésped
intermediario;
- reducción de
la contaminación del agua o del contacto con esta;
- vacunación;
- modificación
de las condiciones de vida de las poblaciones expuestas;
- educación para
la salud.
Los medicamentos
utilizados para eliminar los parásitos no impiden la reinfección,
de allí la necesidad de desarrollar una vacuna eficaz. Se
debe considerar, entre tanto, que los esquistosomas son parásitos
multicelulares que no se multiplican ni se dividen en el organismo humano,
o sea, caso no haya reinfección, y exceptuándose algunos parásitos
que mueren "de vejez", una población de esquistosomas permanecen relativamente
estable y los parásitos adultos, cuyo papel patogénico específico
es extremamente débil, son los que inducen la inmunidad. En
modelos experimentales y matemáticos se concluye que, para reducir
practicamente a cero la incidéncia de la enfermedad bastaría
reducir de manera significativa la "masa" parasitária. Así,
existen perspectivas promisoras en cuanto a la posibilidad de desarrollar
una vacuna eficaz y efectiva, siendo que para este fin que están
envueltos aproximadamente 15 grupos de pesquisa en todo el mundo.
La Organización Mundial de la Salud, a través de la formación
de un comité de especialistas de la enfermedad, elaboró un
documento, publicado en 1993, con las siguientes conclusiones sobre las
estrategias para el control de la enfermedad:
- control de la morbidad
por medio de la utilización de quimioterapia, siendo otras grandes
intervenciones basadas en la educación para la salud y el estabelecimiento
de fuentes de agua no contaminadas, representan medidas factibles y eficaces;
- el control de la endemia
es eficaz cuando forma parte del sistema de atención integral de
salud de la población y cuando el sistema de atención primaria
a la salud es bien desarrollado y capacitado para atender las necesidades
de esta población; los avances difieren en relación al control
de las varias formas de esquistosomiasis y deben ser adaptados de acuerdo
con la epidemiología de la enfermedad, los recursos y la cultura
de los diferentes países; el control de la esquistosomosis debe ser
encarado como una meta a largo plazo donde debe siempre haber un comprometimiento
serio para a su implementación. En cuanto los objetivos a corto
plazo para la reducción de la prevalencia pueden ser alcanzados en
2 años en muchas áreas, un, sistema de vigilancia epidemiológica
debe ser mantenido y conducido por 10 a 20 años.
Ya existen
numerosas evidencias acumuladas mostrando que las condiciones socio-económicas
estan fuertemente asociadas a las tasas de morbidad y de invalidez, para
varias enfermedades, como la esquistosomosis. Asociado a este hecho,
la implementación de la asistencia primaria a la salud, con el reconocimiento
de que la salud de una población es influenciada no solo por los
servicios de salud, más también por una serie de factores ambientales,
sociales y económicos, se presenta como importante factor para a
consolidación de estrategias de control. Condiciones básicas
de sobrevivencia y de educación deben ser los alicientes de todo
proyecto que vislumbre el control de la esquistosomiasis, siendo la participación
de la población en todo el proceso de control de la enfermedad un
factor de irrefutable importancia.
Resumen
La esquistosomiasis,
mansoni, ya por su prevalencia, ya sea por su re-emergencia, es una de
las enfermedades parasitarias de mayor impacto en el mundo. En el
presente artículo, son discutidos aspectos relativos a la esquistosomiasis
mansoni, dentro de una perspectiva brasileira.
Palabras claves:
Esquistosomiasis Mansoni; Revisión; Brasil; Enfermedades Parasitarias.
Bibliografía
-
Almeida
Machado P. The brazilian program for schistosomiasis control. American
Journal of Tropical Medicine and Hygiene, 31: 76-86, 1982.
-
Atidrade
Z & Rocha H. Schistosomial glomerulopathy. Kidney International,
16: 23, 1979.
-
Andrade
ZA. The situation of hepatoesplenie schistosomiasis in Brazil today.
Memórias do Instituto Oswaldo Cruz, 93 (stippl. 1): 313-316,
1998.
-
Argento
CA & Figueiredo N. Porque e o que fazer no tratamento específico
da esquistossomose. Ars cvrandi, 17: 116, 1984.
-
Bina
JC. 0 tratamento específico como arma no controle da esquistossomose.
Memórias do Instituto Oswaldo Cruz. 87 (suppl. IV): 1-9,
1992.
-
Bina
JC. Estudo das variáveis que podem influenciar na evolução
da esquistossomose mansônica: efeito da terapêutica específica
e da interrupto da transmissão. Tese de doutoramento.
Salvador, Universidade Federal da Bahia, 1995.
-
Boros
DL & Whitfield IR. Enhanced Th 1 and dampened Th2 responses synergize
to inhibit acute granulomatous and fibrotic response in murine schistosomiasis
mansoni. Infectious Immunology, 67:1187-1193, 1999.
-
Carvalho
JAM & Barros Coelho R. Incidência da esquistossomose pulmonar
em Pernambuco. Anais da Faculdade de Medicina da Universidade Federal
de Pernambuco, 20: 361, 1960.
-
Cavalcanti
MG, Fernandes EF, Carvalho MA, Siqueira-Batista R & Ramos Junior AN.
Imunologia. In: Huggins DW, Siqueira-Batista R, Medeiros LB &
Ramos Junior AN. Esquistossomose Mansoni. São Paulo, Grupo
Editorial Morcira Jr., 1998.
-
Centro
de Doenças Regionais (CEDRE). Aspectos peculiares da infecção
pelo Schistosoma mansoni. Universidade Federal da Bahia, Bahia, 1984.
-
Comité
OMS d'experts de la lutte contre la schistosomiase. Impact de la
schistosomiase sur la sante publique: morbidité et mortalité.
Bulletin de I'Organisation mondiale de la Santé, 72 (1):
5-11, 1994.
-
Conceição
MJ, Argento CA, Chagas VLA, Takiya CM, Moura DC & Silva SCF. Prognosis
of schistosomiasis mansoni patients infected with hepatitis B virus.
Memórias do Instituto Oswaldo Cruz, 93 (Suppl. 1): 255-258,
1998.
-
Conceição
MI, Corrêa A, Teixeira A, Moura DC, Silva OC & Silva SCF.
Partial lack of susceptibility to Schistosoma mansoni infection of Biomphalaria
glabrata strains from Itanhomi (Minas Gerais, Brazil), after fourteen years
of laboratory maintenance. Memórias do Instituto Oswaldo
Cruz, 94: 425-426, 1999.
-
Conselho
de Desenvolvimento Social (CDS). Programa especial de controle da
esquistossomose no Brasil. Instituto Brasileiro de Geografia e Estatística,
1976.
-
Corrêa
AD, Siqueira-Batista R, Ramos Júnior NA, Guimarães APO, Fonseca
MS & Gomes AP. Epidemiologia. In: Huggins DW, Siqueira-Batista
R, Medeiros LB & Ramos Júnior AN. Esquistossomose Mansoni.
São Paulo, Grupo Editorial Moreira Ir., 1998.
-
Coura
JR. Esquistossomose aguda autóctono de foco na cidade do Rio
de Janeiro: estudo de 22 casos. Revista da Sociedade Brasileira
de Medicina Tropical, 4:387, 1970.
-
Coura
JR. Esquistossomose pulmonar. Estudo clínico e experimental.
Editora Cultura Médica, Rio de Janeiro, 1979.
-
Coura
JR, Mendonça MZG & Madruga JP. Tentativa de avaliação
do Programa Especial de Controle da Esquistossomose (PECE) no Estado da
Paraiba, Brasil. Revista da Sociedade Brasileira de Medicina Tropical,
20:67~76, 1982.
-
Coura
JR, Conceição MI & Pereira JB. Morbidade da esquistossomose
mansoni no Brazil. III - Estudo evolutivo em uma área endémica
no período de dez anos. Memórias do Instituto Oswaldo
Cruz, 79: 447-453, 1984.
-
Coutinho
A & Domingues ALC. Specific treatment of advanced schistosomiasis
liver disease in man: favorables results. Memórias do Instituto
Oswaldo Cruz, 82: 335-340, 1987.
-
Da Silva
SP. Estudo da ação do praziquantel sobre as propriedades
da adesão e contração do Schistosoma mansoni in vitro.
Tese pelo Departamento de Farmacologia Básica e Clínica,
Instituto de Ciências Biomédicas, Universidade Federal do
Rio de Janeiro, Rio de Janeiro, 1993.
-
Davis
A. Operations research in schistosomiasis control. Tropical Medical
Parasitology, 40 (suppl. 2): 125-129, 1989.
-
Dominguez
CA & Borges IJ - La mielitis producida por el Schistosoma mansoni.
Archivos Venezoelanos de Medicina Tropical y Parasitologia Medica,
4: 129, 1962.
-
Fishelson
Z. Novel mechanisms of immune evasion by schistosoma mansoni. Memórias
do Instituto Oswaldo Cruz, 90: 289, 1995.
-
Fonseca
ASA. Esquistossomose aguda autóctone no municipio de Paracambi,
Rio de Janeiro. Revista Medicina (HUPE/UERJ), 3:16, 1984.
-
Gomes
AP. Imunologia & patogênese da infecção pelo
Schistosoma mansoni. Jornal Brasileiro de Medicina (no prelo).
-
Huggins
DW. Esplenoportografia transparietal. Revista Brasileira
de Medicina, 24:6, 1967a.
-
Huggins
DW. Esplenoportografia transparietal: acidentes e complicações.
Folha Médica (BR), 55:1013, 1967b.
-
Huggins
DW. Miocardite esquistossomótica granulomatosa. Anais
da Escola Nacional de Saúde Pública e Medicina Tropical (Lisboa),
3:89, 1969.
-
Huggins
DW. Estenose esquistossomótica do intestino delgado: relato
de um caso. Anais do Instituto de Higiene e Medicina Tropical (Lisboa),
2: 501, 1974.
-
Huggins
DW. Tratamento da esquistossomose mansônica com oxamniquine
(UK-437 l). Folha Médica (BR), 75:27, 1977.
-
Huggins
DW. Praziquantel - Nova opção para o tratamento da
esquistossomose mansônica. Anais do XXVIII Congresso Brasileiro
Gastroenterologia. Sáo Paulo, 1982.
-
Huggins
DW. Esquistossomose rnansoni. Revista Portuguesa de Doenças
Infecciosas, 11:131, 1988.
-
Huggins
DW, Medeiros LB, Siqueira-Batista R, Ramos Júnior AN, Faria EC &
Bertocchi APF. Evolução Clínica. In: Huggins
DW, Siqueira-Batista R, Medeiros LB & Ramos Júnior AN. Esquistossomose
Mansoni. São Paulo, Grupo Editorial Moreira Ir., 1998a.
-
Huggins
DW, Medeiros LB, Siqueira-Batista R, Ramos Júnior AN, Gomes AP &
Argento CA. Diagnóstico Laboratorial. In: Huggins DW, Siqueira-Batista
R, Medeiros LB & Ramos Júnior AN. Esquistossomose Mansoni.
São Paulo. Grupo Editorial Moreira Jr., 1998h.
-
Huggin,
DW, Medeiros LB, Ramos Junior AN, Siqueira-Batista R & Almeida EPT.
Investigação por métodos complementares. In:
Huggins DW, Siqueira-Batista R, Medeiros LB & Ramos Júnior AN.
Esquistossomose Mansoni. São Paulo, Grupo Editorial Moreira
Jr., 1998c.
-
Huggins
DW, Medeiros LB, Quintas LEM, Ramos Júnior AN, Siqueira-Batista R
& Sforza-de-Almeida MP. Tratamento. In: Huggins DW, Siqueira-Batista
R, Medeiros LB & Ramos Júnior AN. Esquistossomose Mansoni.
S
-
Jernigan
JA & Pearson RD. Antiparasitic agents. In Mandell DA, Douglas
G & Bennet JE. Principles and Practice of Infectious Diseases. 4a-
edição, Churchil Livingstone. New York. 1995.
-
Katz
N & Brener Z. Evolução clínica de 112 casos de esquistossomose
mansoni observados após 10 anos de permanéncia em focos endémicos
de Minas Gerais. Revista do Instituto de Medicina Tropical de São
Paulo, 8: 139, 1966.
-
K,
Dias P. Araújo N & Souza CP. Estudo de uma cepa de Schistosoma
mansoni resistente a agentes esquistossomicidas. Revista da Sociedade
Brasileira de Medicina Tropical, 7: 381-387, 1973.
-
Katz
N & Rocha RS. Double-blind clinical trial comparing praziquantel
with oxamniquine in schistosomiasis mansoni. Revista do Instituto
de Medicina Tropical de São Paulo, 24:310, 1982.
-
Katz
N. Brazilian contribuitions to epidemiological aspects of Schistosomiasis
mansoni. Memórias do Instuto Oswaldo Cruz, 87(suppl.
IV): 1-9, 1992.
-
Katz
N. Schistosomiasis control in Brazil. Memórias do Instituto Oswaldo
Cruz, 93 (Suppl. 1): 33-35, 1998.
-
Kawazoe
V & Pinto ACM - Importãncia epidemiológica de alguns
animais silvestres na esquistossomose mansónica. Revista
de Saúde Pública, 17:345, 1983.
-
Kelner
S. Avaliação crítica da cirurgia na hipertensão
portal esquistossomótica. Memórias do Instuto Oswaldo
Cruz. 87:1-9, 1992.
-
Klotz
F, Hovette P, Mbaye PS, Fall F, Thiam M & Cloatre G. Pulmonary manifestations
of schistosomiasis. Revue Pneunioligie Clinique. 54:353-358,
1998.
-
Lambertucci
JR. A double-blind trial with oxamniquine in chronic schistosomiasis
mansoni. Transactions of Royal Society of Tropical Medicine and
Hygiene, 76:751, 1982.
-
Lambertucci
JR. Treatment of the acute (toxemic) phase of schistosomiasis mansoni.
Transactions of Royal Society of Tropical Medicine and Hygiene, 82:
350,1988.
-
Lambertucci
JR. Acute schistosomiasis: clinical, diagnostic and therapeutic features.
Revista do Instituto de Medicina Tropical de São Paulo, 35:399.
1994.
-
Lambertucci
JR & Barravieira B. Esquistossomose mansónica. Estudo
clínico. Jornal Brasileiro de Medicina, 67: 59, 1994.
-
Lenzi
HL, Lenzi JA, Kerr IB, Antunes SLG, Mota EM & oliveira DN. Extracellular
matrix in parasitic and infectious diseases. Memórias do
Instituto Oswaldo Cruz, 86 (Suppl. 111): 77-90, 1998, 1991.
-
Lenzi
HL, Kimmel E. Schechtmann H. Pelajo Machado M. Romanha WS. Pacheco
RG, Mariano M & Lenzi JA. Histoarchiteture of schistosomal granuloma
development and involutions: morphogenetic and biomechanical approaches.
Memórias do Instituto Oswaldo Cruz, 93 (Suppl- 1): 141-151.
1998.
-
Lopez
F. Siqueira-Batista R, Farinazzo RJM, Ramos Júnior AN & Gomes
AP. Patologia. In: Huggins, DW. Siqueira-Batista R, Farinazzo
RJM, Ramos Júnior AN. Esquistossomose Mansoni. São
Paulo. Grupo Editorial Moreira Jr., 1998.
-
Lutz
A – Camarujo de agua doce do género Planorbis observados no Brasil.
Memórias do Instuto Oswaldo Cruz, 10:65, 1918.
-
Malaquias
LC. Cytokine regulation of human imnune response to Schistosoma mansoni:
analysis of the role of 11.-4, IL.-5 and IL.-10 on peripheral blood mononuclear
cell responses. Scandinavian Journal of Immunology, 46(4):393-8,
1997.
-
Malta
J. Esquistossomose mansónica. Recife, Editora Universitária
da Universidade Federal do Pernambuco, 1994.
-
Manson-Bahr
PEC & Apted FIC. Manson's Tropical Diseases. 8th ed. Balliére
Tindall, London,1982.
-
Meira
JA. Quadro clínico da esquistossomose mansónica.
Revista Brasileira de Malariologia e Doenças Tropicais.
11:247, 1959.
-
Moura
Júnior AE. Síndrome nefrótica secundária
a esquistossomose. Scientia Medica, 1:77. 1995.
-
Neves
J & Cunha AS. Esquistossomose mansoni. In: Neves J - Diagnóstico
e Tratamento das Doenças Infecciosas e Parasitárias.
Editora Guanabara Koogan, Rio de Janeiro, 1978.
-
Organización
Mundial de la Salud. Lucha contra la esquistosomiasis. Serie
de Informes Técnicos 515, OMS, Ginebra, 1973.
-
Organización
Mundial de la Salud. Control de la esquistosomiasis. Serie
de Informes Técnicos 728, OMS, Ginebra, 1985.
-
Organización
Mundial de la Salud. La educación sanitária em la lucha
contra la esquistosomiasis, Serie de Informes Técnicos 820, OMS,
Genebra, 1991.
-
Organización
Mundial de la Salud. Control de la esquistosomiasis. Serie
de Informes Técnicos, 830, OMS, Ginebra, 1993.
-
Paraense
WL. Estado atual da sistemática dos planorbídeos brasileiros
(Mollusca, Gastropoda). Arquivos do Museo Nacional, 55:105,
1975.
-
Pessoa
SB. Parasitologia Médica. 8a ed. Editora Guanabara Koogan,
Rio de Janeiro, 1972.
-
Prata
A & Bina JC. Development of the hepatoesplenic form of schistosomiasis.
Gazeta Médica da Bahia, 68:49-60. 1968.
-
Prata
A. Influence of the host factors in the development of the hepatosplenic
form of Schistosomiasis mansoni. Memórias do Instituto Oswaldo
Cruz. 8 (suppl. IV): 1-9, 1992.
-
Prata
A. Esquistossomose Mansoni. In: Veronesi R & Foccacia R. Tratado
de Infectologia. Rio de janeiro, Atheneu, 1997.
-
Quintas
LEM, Siqueira-Batista R, Corréa AD & Lemos-da-Silva 0. Tratamento
da esquistossomose. Revista Brasileira de Medicina, 50: 683,
1993.
-
Ramos
Júnior. AN & Quintas LEM. Bases terapéuticas
da esquistossomose mansoni. Arquivos Brasileiros de Medicina,
70: 577-578, 1996.
-
Ramos
Júnior AN. Siqueira~Batista R, Huggin, DW, Cavalcanti MG.
Cerbino Neto J & Gomes AP. Perspectivas. In: Huggins DW,
Siqueira~Batista R, Medeiros LB & Ramos Júnior AN. Esquistossomose
Mansoni. São Paulo, Grupo Editorial Moreira Jr., 1998.
-
Ramaswamy
K. ICAM-1 and ¡NOS expression increased in the skin of mice after
vaccination with gamma-irradiated cercarie of Schistosoma mansoni.
Experimental Parasitology, 86:118-32, 1997.
-
Rey
L. Prevenção dos riscos para saúde decorrentes dos empreendimentos
hidráulicos. Revista Médica de Moçãmbique,
1:55, 1982.
-
Rey
L. Estratégias e métodos de controle da esquistossomose. Cadernos
de Saúde Pública, 3:38,1987.
-
Rey
L. Parasitologia. 2a ed. Editora Guanabara Koogan, Rio de Janeiro,
1992.
-
Ribeiro
AC, Maldonado Júnior A, D' Andrea PS, Vieira GO & Rey L. Susceptibilility
of Nectomys rattus (Pelzen, 1883) to experimental infection with Schistosoma
mansoni (Sambon, 1907): a potential reservoir in Brazil. Memórias
do Instituto Oswaldo Cruz, 93 (suppl 1): 295-299, 1998.
-
Rocha
MOC, Rocha RL, Coelho PMZ. Pedroso ERP & Rabello AL. Relação
entre a morbidade, carga parasitária e resposta immune na infecção
esquistossomótica murina. Revista da Sociedade Brasileira
de Medicina Tropical, 27 (suppl 1):24, 1994.
-
Siqueira-Batista
R, Corréa AD & Huggin DW. Moléstia de Chagas. Editora
Cultura Médica, Rio de Janeiro, 1996.
-
Siqueira-Batista
R. Contexto de formação da sociedade brasileira: impactos
sobre a saúde. Arquivos Brasileiros de Medicina, 70: 531-537,
1996.
-
Siqueira-Batista
R, Ramos Júnior AN, Faria EC. Farinazzo RJM & Huggins DW.
Esquistossomose mansoni en sua forma crónica. Aspectos clínicos.
Revista Brasileira de Medicina, 54: 835-839, 1997.
-
Siqueira-Batista
R, Ramos Júnior AN, Farinazzo RJM & Fonseca MS. 0 Schistosoma
mansoni. In: Huggins DW, Siqueira-Batista R. Medeiros LB & Ramos
Júnior AN. Esquistossomose Mansoni. São Paulo,
Grupo Editorial Moreira Jr., 1998.
-
Siqueira-Batista
R, Gomes AP, Quinta LEM, Conceição MJ, Freitas E, Wilkins
D. Huggins DW & Argento CA. Esquistossomoses humanas. In: Siqueira-Batista
R, Gomes AP. lgreja RP & Huggins DW. Medicina Tropical.
Rio de Janeiro, Cultura Médica, 2001.
-
Siqueira-Batista
R, Santos SS, Gomees AP, Huggins DW & Conceição MJ. Esquistossomose
mansoni. Revista da Faculdade de Medicina de Teresópolis
(submetido).
-
Strickland
GT. Hunter's Tropical Medicine. 6th ed. WB Saunders Co, Philadelphia,
1986.
-
Vahia-Loureiro
AM, Ramos Júnior AN & Siqueira-Batista R. Histórico.
In: Huggins DW, Siqueira-Batista R, Medeiros LB & Ramos Júnior
AN. Esquistossomose Mansoni. São Paulo, Grupo Editorial Moreira
Jr., 1998.
-
Warren
KS. Pathophysiology and pathogenesis of schistosomiasis mansoni.
Bulletin of New York Academy of Sciences, 44: 280-294, 1968.
- Warren KS. The
immunopathogenesis of schistosomiasis: a multidisciplinary approach. Transactions
of Royal Society of Tropical Medicine and Hygiene, 66: 432, 1972.
* Professor de la
Faculdade de Medicina de Teresópolis, Fundação Educacional
Serra dos órgãos (FMT - FESO). Médico tropicalista
e Especialista en Enfermedades Infecciosas y Parasitarias por la Universidad
Federal de Rio de Janeiro. Columnista Médico Experto de la
Sociedad Iberoamericana de Información Ciéntífica (SIIC).
** Professora de la Faculdade
de Medicina de Teresópolis, Fundação Educacional Serra
dos órgãos (FMT - FESO). Especialista en Enfermedades
Infecciosas y Parasitarias por la Universidad Federal de Rio de Janeiro.
Mestría en el Departamento de Medicina Tropical, Instituto Oswaldo
Cruz, Fundación Oswaldo Cruz (FIOCRUZ). Columnista Médico
Experto de la Sociedad Iberoamericana de Información Ciéntífica
(SIIC).
*** Mestría en el
Departamento de Medicina Tropical, Instituto Oswaldo Cruz, Fundación
Oswaldo Cruz (FIOCRUZ).
**** Professor de la Faculdade de Medicina
de Teresópolis, Fundação Educacional Serra dos Órgãos
(FMT - FESO). Especialista en Clínica Médica, Sociedad
Brasileira de Clínica Médica.
***** Profesor Adjunto de
la Disciplina de Enfermedades Infecciosas y Parasitarias. Universidad
Federal de Pernambuco (UFPE). Membership de la Asociación
Americana para el Desarrollo de la Ciencia.



