NEUMOLOGÍA
KETOTIFENO EN ASMA
Mario Ingianna Acuña ***, Alcibey Alvarado González ***
Summary
The discovery of Sodium Cromoglicate represents a
remarkable progress in the management of asthma. However, due its poor
solubility and inability to be reabsorbed the galenic form of this agent its a
major disadvantages in clinical practice. This has stimulated numerous
efforts to rind active and well-tolerated peroral therapeutical agents. A
new therapeutical agent (HC20-511), Ketotifen, wich belongs chemically to the
cycloheptathiphene group of sustance, was shown to exhibit several
pharmacological properties in the field of antiallergic activity. This
sustance proved to have a very low levels of toxicity and furthermore, was
rapidly and completely absorbed through the gut. We report a clinical
trial, testing the effect of Ketotifen in an out-patient asthmatic subjects
with moderate or mild bronchial asthma. The efficacy and safety of ketotifen
was confirmed. In conclusion, Ketotifen is a promising drug for the
prophylaxis of asthma.
Introducción
El Ketotifeno es un
derivado tricíclico del grupo benzocycloheptathifeno (66, 30), con varias propiedades farmacológicas que incluyen
actividad antianafiláctica, estabilización de mastocitos, actividad
antihistamínica e inhibición de la fosfodiesterasa (105).
También se ha demostrado que puede inhibidir la broncoconstrucción dependiente
del factor agregador plaquetario (86) y mejora la función de
los receptores beta (52). Por estas razones se le
considera una droga antialérgica y antihistamínica. En experimentos en animales
inhibe la anafilaxia cutánea pasiva y el asma experimental en ratas (119).
En trabajos a corto
plazo protege a los pacientes asmáticos contra el espasmo bronquial inducido
por antígenos, histamina y aspirina, pero no por acetilcolina (105).
El efecto protector
contra la reacción inmediata así como a la reacción tardía por exposición a
antígenos ha sido considerada como parcial (28). Menos
claro es aún el papel que juega en la profilaxis del asma inducida por
ejercicio. (95). Algunos estudios clínicos reportan que
Ketotifeno tiene valor profiláctico en el asma (52, 31, 76, 62, 67)
y otros un efecto leve o ausente en controlar los síntomas asmáticos (28). Dada la controversia planteada en la literatura con
esta droga, nosotros decidimos publicar nuestros resultados en un estudio
diseñado para definir la eficacia del Ketotifeno en términos de disminución de
los síntomas y reducción de la medicación concomitante, así como la seguridad
del medicamento y los efectos secundarios.
Material y métodos
A)-
Selección de los pacientes.
Los pacientes
tuvieron que cumplir los siguientes criterios de inclusión para entrar el
estudio:
- Edad de un año a 60 años. (Niños de 1 a 12 años; adolescentes de 13 a 18 años y adultos de 19 a 60 años).
- Síntomas permanentes de asma bronquial con componente inmunológico no reversible completamente con tratamiento convencional (Beta-2 agonistas y teofilina), pero catalogable de leve a moderada.
- Dos a ocho crisis de asma al mes al menos en los últimos 6 meses previo al inicio del estudio.
- Criterios opcionales agregados al asma fueron los datos de rinitis alérgica, dermatitis alérgica, eczema, coriza espasmódica y conjuntivitis atópica.
- Al momento de ingreso al estudio no debía existir infección respiratoria aguda ni ataques prolongados de asma en los últimos 15 días.
B)-
Criterios de exclusión.
Fueron excluidos del
protocolo los pacientes que tuviesen concomitantemente tirotoxicosis no
controlada, desórdenes cardíacos, diabetes mellitus, psicosis, enfermedades
gastrointestinales, hepáticas o renales que pudieran interferir con el
metabolismo, absorción o excreción de la droga en estudio. También se
excluyeron los pacientes con administración crónica de drogas depresivas del
Sistema Nervioso Central tales como sedantes, hipnóticos o
antihistamínicos. Los pacientes que recibieron desensibilizantes en los
últimos 3 meses previo al estudio o que recibían esteroides o cromoglicato
también fueron excluidos. Otros criterios de exclusión fueron: infección
intercurrente del tracto respiratorio inferior, bronquitis crónica,
bronquiectasias, fumando, mujeres embarazadas, que pudieran embarazarse o que
estuvieran amamantando a sus hijos, así como los pacientes con historia
reciente de infarto del miocardio (52, 32, 40, 110, 21, 57,
109) e ingesta de eritromicina, barbitúricos,
fentoina o salicilatos (38).
C-) Diseño del estudio.
El estudio fue concebido
originalmente como un estudio abierto, el cual incluyó un grupo inicial de 75
pacientes que cumplieron los criterios seleccionados. El período mínimo
del estudio fue de 12 semanas. Este período se escogió en base a la
información que existe en la literatura, la cual demuestra en estudios previos
controlados que es el período necesario para demostrar su eficacia en el
tratamiento profiláctico del asma bronquial (20, 60,
32, 49, 11, 51,
91). Los pacientes (y en el caso de los niños previo
consentimiento de los padres ingresaron voluntariamente al estudio, después de
explicarles el protocolo (el consentimiento informado fue obtenido en cada
caso). Quince pacientes no pudieron terminar el protocolo y fueron
excluidos del estudio: diez pacientes porque no terminaron el lapso mínimo de
12 semanas (en dos casos debido a crisis asmáticas que requirieron
internamiento y suspensión del medicamento y agregar otras drogas que
interferían con el estudio. Los ocho casos restantes debido a que
incurrieron en algunos de los criterios de exclusión citados antes). Los
otros cinco pacientes no volvieron a control después de la primera cita.
Todos los pacientes fueron estudiados en la Consulta Externa del Hospital San
Juan de Dios, o en la práctica privada de los autores. Después del
período inicial de 12 semanas el diseño del estudio cambió pues 50 pacientes
pudieron continuar con el medicamento (grupo I) y 10 pacientes tuvieron que
suspender la terapia pues no tuvieron acceso a la droga en estudio (grupo
II). El resto del tratamiento convencional (B-2 agonistas y teofilina) no
se suspendió. Desgraciadamente no se disponía del placebo adecuado (pues
el estudio no se diseñó originalmente para comparar con placebo) para mantener
estos 10 pacientes con placebo y el grupo 1 con el Ketotifeno).
Una opción que se consideró fue comparar con cromoglicato pero se desechó pues
los dos grupos habían recibido originalmente el Ketotifeno y el grupo II
hubiese recibido una forma inhalada diferente a la oral, lo cual pudo haber
conducido a falsas conclusiones y además, el cromoglicato faltaba en ese
momento en la farmacia del H.S.J.D. Por estas razones ambos grupos I (50
pacientes) y II (10) pacientes se continuaron estudiando durante un período de
6 meses más. Debe quedar claro que el grupo I siempre recibió el
Ketotifeno y el grupo II no recibió ni Ketotifeno ni Cromoglicato
disódico. Al final de los 6 meses al grupo II se le pudo reiniciar de
nuevo el Ketotifeno y el grupo I lo mantuvo ininterrumpidamente hasta llevarlos
a un período de observación de 30 meses a los 60 pacientes con la droga.
D-) Parámetros estudiados.
Los objetivos básicos a estudiar fueron la disminución de los síntomas
asmáticos, la reducción en la medicación concominante, los efectos secundarios
y los cambios en las pruebas de función pulmonar. El medicamento
utilizado, el Ketotifeno (Zaditen, Sandoz) se usó en las dosis que pueden verse
en la tabla 1, para mantener una concentración en sangre
entre 1-2 ng/ml (119).
La presentación pediátrica consistió de un jarabe conteniendo 1 mgr por 5
ml. La presentación de adultos consistió de tabletas de 1 mgr. (73). Existen tabletas de liberación prolongada para uso
nocturno de 2 mgrs y también gotas pediátricas pero no fueron usadas en este
trabajo. Los pacientes fueron examinados en la mañana del primer día y
les fue llenado el protocolo y posteriormente se entrevistaron cada 2 semanas
hasta el cierre del estudio (73). En la valoración del
asma se tomó en cuenta la intensidad, frecuencia y duración de los ataques de
asma, de acuerdo a un cuestionario precodificado. La disnea diurna y
nocturna se graduaron en una escala de 0 a 3 como puede verse en la tabla II (21, 60), y III. La tos se valoró de acuerdo a una escala
semejante (tabla IV) (57).
Durante cada visita se procedió a realizar un examen físico general, con los
signos vitales y se puso énfasis en la semiología broncopulmonar graduándose de
0 hasta 4 espasmo bronquial (tabla V) (31).
Los exámenes realizados cada mes incluyeron: hemoglobina, hematocrito,
leucograma, nitrógeno ureico, creatinina, ácido úrico, glucemia, transaminasa
glutámico-oxalecética y pirúvica, fosfatasa alkalina, deshidrogenenasa láctica,
bilirrubinas, proteínas (albúmina y globulinas), calcio, fósforo, colesterol y
triglicéridos (105).
|
Peso en Kg |
Dosis |
|
14-18 |
0.4 mg
bid (2 ml. bid) |
|
Grado |
Disnea diurna |
|
0 |
Ausente |
TABLA 3
GRADUACION DE LA DISNEA NOCTURNA
|
Grado |
Disnea Nocturna |
|
0 |
Asintomático
por la noche |
|
Grado |
Característica de la tos |
|
0 |
Ausente |
TABLA 5
GRADUACION DEL ESPASMO BRONQUIAL
|
Grado |
Espasmo Bronquial |
|
0 |
a)
Pulmones y boca claros (sin sibilancias) |
1 FR frecuencia Respiratoria
2 PEF = Pico Espirado
de Flujo. El número en porcentaje es el valor real con respecto al predicho.
La cuantificación de IgE total
fue realizada al inicio del estudio por el método de radioinmunoanálisis (102, 105) en discos de papel (Phadebas
PRIST). Aunque el valor normal reportado en la literatura oscila entre
80-100 u/ml, nosotros decidimos usar el valor mínimo de 150 u/ml, debido a que
valores inferiores pueden encontrarse en pacientes atópicos con infecciones
parasitarias (46). Posteriormente la1gE fue evaluada
cada 4 meses desde que los valores correlacionan con la respuesta al tratamiento
(120). A los pacientes adultos se les realizó Pruebas
de función pulmonar (PEFR, FEVI, FEVI/FVC, FVC, e índices y cada mes durante 12
meses en un equipo automatizado (Ohio Medical Products Model 840) realizándose
tres pruebas basales y escogiendo como representativa la que dio el valor
mayor. Para considerar una respuesta significativa a los
broncodilatadores el FEV1 y la FVC deben mejorar al menos un 20% y las pruebas
de pequeña vía al menos un 75% (128). Se realizó también una medición
semanal del PEF con un flujómetro Miniwright, ya que este es un parámetro
estable (82) como ha sido demostrado en estudios del flujo
aéreo (3).
Un registro diario de la medicación concomitante usada fue anotado por los
pacientes o los padres de ellos para cuantificar el uso de la misma antes,
durante y al final del tratamiento (15, 112).
La idea era revisar si el uso del Ketotifeno disminuía el consumo del
tratamiento convencional. La radiografía de tórax se realizó en cada
paciente solo al inicio del estudio ya que las anormalidades radiológicas en
asma no complicada son muy infrecuentes y casi ninguno de los hallazgos ayudan
en el manejo clínico de los pacientes (36).
El diagnóstico de asma alérgica se basó en una historia clínica completa, el
examen físico, la confirmación de obstrucción de grandes y/o pequeñas vías
aéreas con hiperreactividad bronquial, IgE superior a 150 u/ml y más de 500
eosinófilos por cc de sangre periférico y se exigió que los pacientes
cumpliesen todos los criterios diagnósticos de la American Thoracic Society (4). La valoración total de la eficacia fue realizada por el
médico y el paciente cada mes hasta terminar el protocolo (4).
Dicha valoración se hizo en base a la evaluación clínica, funcional y fue
determinada por el médico usando una escala de cero a cuatro como se detalla a
continuación:
0 = Ninguna respuesta.
1 = Leva a regular.
Reducción en la ingesta de otros medicamentos sintomáticos pero no desaparición
de los síntomas.
2 = Moderada. Asintomáticos del asma pero sin poder suspender los
medicamentos sintomáticos concomitantemente.
3 = Buena. Asintomáticos por completo y requiriendo solo ocasionalmente
medicación sintomática.
4 = Muy buena. Ausencia completa de los síntomas sin requerir ninguna
medicación concomitante ni siquiera ocasionalmente (60, 80).
La tolerancia fue también investigada en busca de efectos adversos tanto
clínicos como por la extensa evaluación de laboratorio antes descrita. La
adecuada cooperación profiláctico con el tratamiento del asma bronquial nunca
será lo suficientemente estimuladas para obtener respuestas a largo plazo. En
cada visita el médico dio especial énfasis al uso de la droga, contando incluso
las tabletas sobrantes e insistiendo en la necesidad de las dosis, horarios y
frecuencia (80).
E) Análisis estadístico. Para probar la significancia
se utilizó una prueba unilateral de una cola para dos proporciones y ello fue
aplicado a los dos diferentes grupos bajo estudio del tercero al noveno mes (34, 41).
Resultados
A) Características
de los pacientes. El estudio incluye 60 pacientes, 26 hombres (46.4%) y
34 mujeres (56.6%), en el grupo original. La proporción de pacientes que
continuó recibiendo el Ketotifeno del tercero al noveno mes fue de 83.3%
comparado con un 16.6% que continuó solo con terapia convencional en este
período. (Gráfico l). El 85% de los pacientes en
ambos grupos tuvo una edad promedio inferior a los 36 años (Tabla
VI). Quince pacientes eran niños (25%) y 35 pacientes adultos
(75%). Los niños presentaban asma de muy diverso tiempo de
evolución. En el grupo de adultos la duración promedio de la enfermedad
fue de 5.5 años (rango de 0 hasta 27 años) y todos tenían asma de leve a
moderada. La mayoría de los pacientes tenían asma bronquial con claro
componente inmunológico puro (11.7%) o mixta (88.3%) (Tabla
VII).
RESUMEN GRAFICO DEL
COMPORTAMIENTO DE LOS
60 PACIENTES CON
KETOTIFENO
TABLA 6
DISTRIBUCION POR EDADES
|
Rango de |
# de |
Porcentaje |
|
0-10 |
22 |
36.6% |
TABLA 7
ESTÍMULOS MÁS IMPORTANTES
DESENCADENANTES DE ASMA1
|
Estímulos |
Porcentaje |
|
Infecciones
de vías respiratorias |
78% |
1 Se entiende que muchos pacientes tenían asma
desencadenada por varios estímulos a la vez.
B) Eficacia. La intensidad
de los ataques asmáticos durante el día y la noche, así como el número total de
días con crisis de asma se disminuyó en el grupo tratado con Ketotifeno y al
final del noveno mes hubo una diferencia estadísticamente significativa entre
los. dos grupos en favor del grupo que usó el Ketotifeno. Para valorar la
significancia estadística se utilizó una prueba unilateral (de una cola) para
dos proporciones resultando que si existe diferencia estadística (p=0 o <
0.0001) para rechazar la hipótesis nula de que la proporción de pacientes que
controló los síntomas es la misma para aquellos con o sin el medicamento, por
lo tanto, los pacientes bajo tratamiento con Ketotifeno mostraron una,
proporción significativamente mayor en el control de los síntomas que los
pacientes sin este medicamento. La significancia fue calculada para la
frecuencia y la intensidad de los ataques asmáticos durante el día y la noche
entre el tercero y el noveno mes, así como para el valor promedio de los
resultados durante dicho período (Fig. l). Los
síntomas clínicos y signos (por ejemplo: tos, expectoración, obstrucción),
también mejoraron progresivamente. Al final del estudio el análisis
mostró una diferencia estadísticamente significativa entre los dos grupos para
todos los síntomas, excepto para la conjuntivitis y eczema atópico (Fig. 2). Hubo una leve mejoría en el PEFR y en el FEV
1 en el grupo tratado con Ketotifeno (Fig. 3), pero la
diferencia no fue estadísticamente significativa. En 43% de los pacientes
recibiendo la medicación bajo estudio se redujo el uso concomitante de otros
medicamentos, en comparación con un 27% en los pacientes que no recibieron el
Ketotifeno (p=0 menor de 0.0001). La valoración de la eficacia mostró, al final
del tratamiento, una diferencia estadística significativa (p=O menor de 0.0001)
entre los dos grupos. En los pacientes con ketotifeno el médico catologó
la respuesta de "moderada" o "buena" en el 70% de los
pacientes. Sin Ketotifeno dichas categorías solo llegaron a un 30%.
|
A.A. 1 sin ketotifeno |
F.A.A. 1 con ketotifeno |
|
4.5 |
6 |
FRECUENCIA DE ATAQUES ASMÁTICOS
|
|
|
Frecuencia de ataques de asma (respuestas durante 6 meses). El análisis del punto final (LAST CTRL). (Valores Promedio) mostró diferencia significativa (prueba unilateral p<0.0001) |
C) Efectos
secundarios, cooperación y tolerancia. El efecto secundario mas frecuente
fue "mínima" a "moderada" sedación y somnolencia, los
cuales fueron reportados en el 44% de los pacientes, sobretodo en las dos
primeras semanas de tratamiento. En las sucesivas (semana 4, 6, 8, 10),
la sedación disminuyó a un 11 % y al final del período inicial (semana 12),
solo un 10% de los pacientes presentaba somnolencia. Ningún paciente tuvo
que suspender la droga en estudio, y en el grupo 1 la sedación tendió a
disminuir con el uso contínuo de la droga y el paso del tiempo. Tanto en
el período inicial como en los 6 meses de intervalo (Grupo 1) y luego en ambos
grupos (cuando se reinició el Ketotifeno en el grupo II) la reducción de la
sedación se mantuvo y al final de los 30 meses solo en 5 pacientes (8.3%)
persistió la misma. No hubo diferencias significativas en la presión sistólica
y diastólica ni en la frecuencia cardiaca, así como en el peso entre los dos
grupos en ningún momento del estudio. Tampoco existieron cambios clínicos
significativos ni de laboratorio en el sistema hematopoyético,
gastrointestinal, hepático, renal ni en el cardiovascular.
|
E.B.1 sin ketotifeno |
T.E.B 1 con ketotifeno |
|
3 |
3 |
TOS Y ESPASMO BRONQUIAL
|
Cambios en los síntomas clínicos (tos y espasmo bronquial), El análisis del punti final (valores promedio para 3er y 9no mes) mostró diferencia estadística significativa entre los dos grupos . (Prueba Unilateral p<=0.0001 |
|
FR1 sin ketotifeno |
PEFR 1 con ketotifeno |
|
375 |
340 |
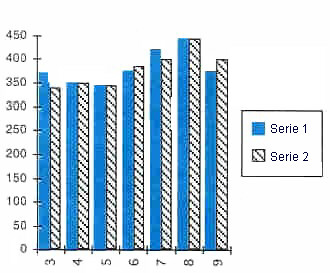
PICO ESPERADO DE FLUJO
(litros/minuto)
Valores promedio y desviación estándar
|
|
|
Cambios en el PEFR. No hubo diferencia estadísticamente significativa entre los 2 grupos. (Pruebas Unilateral). |
Discusión
El
asma bronquial es un síndrome más que una enfermedad en el cual la obstrucción
bronquial y la hiperreactividad son componentes esenciales (41).
Si bien es cierto ambos son características funcionales esenciales en el asma,
la misma es vista hoy en día como una enfermedad inflamatorio (12,
85). Este hecho le ha dado un papel primordial al tratamiento
antiinflamatorio temprano (101). También es un hecho
aparentemente bien documentado de que existe un aumento en la morbilidad y
mortalidad producidos por esta entidad tanto en Inglaterra (37)
como en los Estados Unidos de Norteamérica (64, 87,
89). Más controversias, pero más preocupante, es el
papel que en esta ascendente morbimortalidad pueda jugar el uso de beta-2
agonistas. Los trabajos recientes que relacionaron el fenoterol inhalado
con la aumentada mortalidad no dejaron claro cual podría ser el mecanismo que
aumentara el riesgo de muerte (104) y fueron criticados por
errores de metodología. Ello ha llevado al diseño de trabajos más
objetivos que parecen avalar la conclusión original, sobre todo con el uso del
fenoterol pero queda la duda si dicha aumentada mortalidad es responsabilidad
directa de los Beta-2 o el uso o el abuso de los mismos es un indicador de asma
severa (77, 106).
Tomando en cuenta todas estas
consideraciones es lógico y necesario que parte de las investigaciones que se
realizan en asma estén dedicadas a la búsqueda de nuevos medicamentos altamente
eficaces, con baja toxicidad y que tengan, no solo efecto sintomático, sino
también profiláctico, por ejemplo el uso reciente de inhibidores de
luecotrienos (39). El Ketotifeno es una sustancia que
ha pretendido cumplir estos requisitos (72, 16,
122, 123, 74, 114, 69). Los estudios europeos fueron
originalmente muy optimistas con respecto al efecto profiláctico potencial de
esta droga. Sin embargo, simposios recientes sobre tratamiento del asma
solo mencionan el medicamento marginalmente (101, 117, 88) o no lo mencionan (90)
y aunque se dispone de la droga en Japón y en Europa los estudios realizados en
Estados Unidos de Norteamérica han mostrado una eficacia limitada. De hecho, el
medicamento no ha sido aceptado por la F.D.A. en los Estados Unidos (80).
La mayoría
de los estudios clínicos han mostrado efectividad del asma cuando se compara
con respecto a placebo (80, 17, 68, 42, 50, 13)
aunque existen algunos trabajos que niegan esta eficacia (112,
53, 29, 41, 103).
También se ha demostrado su efectividad al compararlo con teofilina (113) e incluso, que pueden utilizarse combinadas pues la droga
no afecta el perfil farmacocinético de la teofilina (38);
pero también hay estudios que demuestran que el empleo del Ketotifeno puede
reducir significativamente el uso de la misma e incluso permite suspenderla sin
deterioro de la función pulmonar (100). Una propiedad
interesante que se le ha adjudicado es la que puede reducir el uso de esteroides
o aumentar el tiempo entre una dosis y otra ("espaciador de
esteroides") (61, 27, 49),
aunque el mecanismo no es claro (75, 81) y
al menos un trabajo a cuestionado esta importante propiedad (41).
El Ketotifeno ha demostrado que previene la inducción de taquifilaxis que
ocurre con el uso regular de Beta-adrenérgicos (94), e incluso
que mejora la función de los receptores Beta (54, 116), aunque una explicación alterna es que disminuya la
hiperreactividad de las vías aéreas (59). El factor
agregador plaquetario ha sido claramente reconocido como una molécula que se
libera durante la reacción asmática y puede inducir hiper-reactividad bronquial
(118). Algunos trabajos sostienen que el Ketotifeno
claramente inhibe las reacciones patológicas iniciadas por dicho mediador en el
tejido pulmonar (118, 83, 2),
aunque existe al menos un estudio que no logra demostrar una respuesta
protectora contra la hiperreactividad bronquial inducida por el factor
agregador plaquetario en humanos. (28). Como se
mencionó antes, el Ketotifeno es un potente antoganista no competitivo de las
respuestas a histamina (H-1) (86, 52, 119, 28, 95, 31,
76, 67, 40, 57,
38, 102, 41, 20, 74, 114, 17)
y bloquea su liberación y la de otros mediadores, debido a que se inhibe la
actividad de la fosfodiesterasa celular aumentando los niveles de AMP cíclico
intracelular (14). Sin embargo es posible que esta
propiedad no sea la única responsable de su eficacia en el asma (33)
aunque si le confiera valor terapia sintomática en alergias. Con el
transcurso de tiempo y los avances de la inmunología se le han descrito al
medicamento otros mecanismos de acción. Se sabe que el medicamento
disminuye la expresión del receptor IgE-Fc en las células del lavado
bronquiloalveolar de pacientes asmáticos con neumonía eosinofílica (26) y disminuye los niveles de IgE en plasma para algunos
antígenos específicos (55). Pareciera también que el
Ketotifeno puede bloquear, al menos parcialmente, la inducción de la respuesta
de Interleukina-2 de los linfocitos sanguíneos al estimularlos con ciertos
antígenos (93) y que puede prevenir la exacerbación del asma
inducida por el alcohol al inhibir la liberación de radicales superóxidos de
los eosinófilos (58). Los pacientes asmáticos tienen
menor actividad de la enzima metiltransferasa disminuyendo así la fluidez de
las membranas plasmáticas y por lo tanto tienen menos receptores beta.
Pareciera que el Ketotifeno estimula la actividad de la enzima aproximándola al
nivel de los individuos sanos (15). También se ha
demostrado que la droga ejerce una acción estimulante de los linfocitos T
supresores lo que lleva a una disminución del leucotrieno B4 y tromboxano A-2 y
estas acciones correlacionan con la mejoría de la obstrucción bronquial (43).
En el
presente trabajo los síntomas y hallazgos del examen físico en pacientes con
asma moderada fueron significativamente mejorados al compararlo con el grupo
que no usó el medicamento. Al final del tratamiento la eficacia de la
droga fue significativamente mayor con respecto al grupo que no la usó, ya que
un 70% de los pacientes tuvo una respuesta moderada o buena (versus un 30% en
el grupo sin Ketotifeno). Un aspecto que es importante discutir es el
diseño de este trabajo. El patrón fluctuante del asma es un obstáculo en
la investigación clínica particularmente para drogas de acción profiláctica. Si
bien es cierto es relativamente fácil evaluar la actividad de una droga
broncodilatadora pues el efecto puede ser cuantificado directamente, es más difícil
valorar la eficacia de un agente profiláctico desde que existen variaciones en
los episodios de bronco-constricción y el uso del tratamiento broncodilatador
(para tratar dichos episodios) debe ser evaluado concomitantemente. Dado
que el asma es una entidad cambiante con el tiempo y de que el Ketotifeno
requiere un largo período de inducción para que sea clínicamente efectivo (7), un tiempo prolongado de observación con él es
importante. En este sentido 30 meses de observación parece ser un período
aceptable. LO QUE ES CUESTIONABLE DEL DISEÑO ES QUE NO SE CONTROLARA
ESTRICTAMENTE CONTRA PLACEBO (110). La cooperación de
los pacientes o lo contrario es una variable que afecta los resultados de los
trabajo no controlados así como los de los trabajos randomizados (22).
El hecho de que el grupo final (60 pacientes) continuara usando el medicamento
por un período adecuado de observación, de que los resultados obtenidos sean
muy semejantes a los de los trabajos recientes controlados, de que la muestra
para estudiar fuese numéricamente importante y que los resultados tengan
significancia estadística sugiere que las conclusiones son válidas. De
las drogas anti-inflamatorias no esteroideas el cromogliato es la mejor (8, 88). De allí que aunque el trabajo no
fue diseñado para comparar el Ketotifeno con el cromoglicato, la comparación de
cualquier droga anti-inflamatoria bajo investigación debe hacerse con el
cromoglicato de sodio, máxime que en el país se cuenta con ambas drogas.
Aunque el mecanismo de acción no es claramente entendido, la idea original de
que el cromoglicato estabiliza y previene la liberación de mediadores es ampliamente
aceptada (9, 23). Cuando se administra
profilácticamente el medicamento inhibe tanto la reacción inmediata como la
tardía inducida por alergenos y la obstrucción aguda de la vía aérea después
del ejercicio, aire frío y dióxido de sulfuro. Sin embargo no hay forma
fiable de predecir que paciente va o no a responder a la droga y se requiere un
mínimo de 2 a 6 semansa de tratamiento para determinar la eficacia en un
paciente dado (10, 96). El producto
ofrece una adecuada protección en el 50% de los casos y una protección parcial
en otro 25% (23). Contrario a la creencia popular, el
cromoglicato es efectivo no solo en el asma alérgica y en pacientes jóvenes
sino también en pacientes asmáticos adultos y la eficacia no es afectada por el
origen atópico de la enfermedad (47). El cromoglicato
produce solo mínimos efectos secundarios como tos ocasional particularmente con
la presentación en polvo y muy ocasionalmente reacciones severas
anafilácticas. Ello aunado a la ausencia de propiedades neoplásicas y
teratogénicas (5) hacen del medicamento una droga de primera
línea en el tratamiento del asma (22).
Al
analizar la información de los trabajos comparativos entre cromoglicato y
ketotifeno los resultados son muy controversiales (75).
Los estudios iniciales parecían demostrar que la eficacia de ambos era
comparable para el tratamiento profiláctico del asma bronquial y que los
pacientes en tratamiento con cromoglicato podían ser trasladados a ketotifeno (21, 57, 72, 124,
98, 18, 79, 121,
109, 81, 62, 08,
43) e incluso que el Ketotifeno era más eficaz en reducir el
uso de los corticosteroides en pacientes asmáticos corticodependientes que el
cromoglicato (17). Sin embargo, trabajos posteriores no
pudieron demostrar una eficacia similar y tenían en común denominador que
demostraban una eficacia mayor del cromoglicato sobre el Ketotifeno (95, 113, 70, 111).
Debe aclararse que algunos de estos trabajos utilizaron un tiempo menor de 6 a
12 semanas (111) que es el tiempo necesario para que el
Ketotifeno sea eficaz (75, 80, 17,
115). Es claro que 4 semanas de Ketotifeno no tiene
efecto profiláctico en asma bronquial (95, 115),
mientras que en cromoglicato es posible notar la mejoría clínica a los 15 días
de su uso regular (5). Esta discrepancia en el tiempo,
necesario para obtener un efecto dado en el paciente asmático, podría ser
responsable, al menos en parte de las diferencias obtenidas entre los diferentes
trabajos. Un dato interesante es que pesar de la extensa revisión
bibliográfica realizada solo una publicación demuestra (sin datos de
significancia estadística) que el Ketotifeno es altamente eficaz cuando se usa
combinado con cromoglicato (45). Parece poco lógico con
tan escaza información aconsejar el uso profiláctico de ambos medicamentos
concomitantemente máxime que ello aumentaría los costos del tratamiento.
Debemos recalcar al cuerpo médico (y éstos explicarles a los pacientes) que si
se decide utilizar el Ketotifeno no se puede esperar una respuesta antes de
6-12 semanas. Al revisar el efecto que el Ketotifeno tiene en las pruebas
de función pulmonar nos encontramos con el principal argumento que milita en su
contra como agente anti-inflamatorio profiláctico en asma bronquial. Son
pocos los trabajos que demuestran una diferencia estadística significativa en
los índices de flujo aéreo con el uso de la droga (109, 122, 76) y son más los que
no logran demostrar mejoría objetiva funcional con el uso de la droga (95, 73, 79, 62,
70) concepto con el cual concuerda nuestro trabajo en el que
no se lograr demostrar una diferencia sustancial en los índices de flujo ni de
grandes ni de pequeñas vías aéreas con el uso de la droga. Esta es la
razón probablemente por la cual la droga se considera por algunos autores solo
como antihistamínica y le confiere un discutible valor como agente
anti-inflamatorio eficaz. De hecho en trabajos de revisión recientes el
medicamento no se menciona en el arsenal terapéutico (25, 56), o se menciona solo superficialmente como carente de
eficacia clínica (101), que su efecto benéfico es menor (88, 117) o solo es eficaz en asma leve y en
la infancia (6). Estas son las razones por la cual son
pocos los trabajos recientes que definen al Ketotifeno como una droga
claramente anti-inflamatoria (92) o no lo
mencionan (90).
Probablemente
una de las ventajas que tenga la droga es que permite tratar por vía oral la
rinitis, dermatitis y conjuntivitis alérgica (108, 99, 48) asociadas al asma, ventaja que no
tiene el cromoglicato inhalado por boca (debe recalcarse que existe
cromoglicato para uso nasal y conjuntival en el mercado de Costa Rica).
Al usarse por vía oral permite medicar a niños de muy corta edad, ventaja que
no tiene el cromoglicato. Sin embargo, la introducción de los
espaciadores permite utilizar el cromoglicato inhalado en niños cada vez más
pequeños (117, 56) haciendo esta ventaja
muy relativa. De todas maneras es claro en la literatura que el
ketotifeno no ha demostrado ser un anti-inflamatorio superior al cromoglicato
ni que sea un sustituto del mismo. Incluso trabajos recientes sobre
rinitis alérgica ni siquiera lo mencionan como una alternativa (65).
En nuestro trabajo nosotros no logramos demostrar diferencia estadística
significativa para conjuntivitis ni eczema atópico pero si para rinitis
alérgica. La eficacia de otras drogas profilácticas anti-inflamatorias
como el azelastine (65), el nedocromil (ya disponible en el
mercado de Costa Rica) (92) y el picumast dihidrocloruro (107) así como el uso de agentes que reducen el uso de
esteroides, tales como metrotexate (84), troleandomicina y
sales de oro (24) requieren más estudios prospectivos y la
prueba del tiempo. De nuestro trabajo y de la revisión de la literatura
disponible puede concluirse QUE EL KETOTIFENO ES UNA DROGA CONTROVERSIAL EN EL
TRATAMIENTO DEL ASMA. El producto es activo por vía oral en el manejo del
asma y desórdenes alérgicos. La evidencia acumulativa indica que después
de un período de 6-12 semanas de administración el Ketotifeno reduce
significativamente los síntomas respiratorios y la necesidad de drogas
antiasmáticas concomitantes en un 70% y un 50% respectivamente.
Sin embargo, la mejoría absoluta y objetiva de la función pulmonar generalmente
es muy leve. El Ketotifeno también tiene efectos antihistamínicos y
antianafilácticos lo cual puede resultar en una mejoría de moderada a marcada
en los síntomas de muchos pacientes con dermatitis atópica, rinitis constante y
estacional, conjuntivitis alérgica, urticaria aguda y crónica y alergia a
alimentos. Los estudios comparativos con otras drogas profilácticas,
fundamentalmente con cromoglicato indican que aunque en algunos pacientes la
utilidad clínica pueden ser comparables, el Ketotifeno no es un sustituto
superior a cromoglicato, pero puede reducir los síntomas de asma,
conjuntivitis, dermatitis y rinitis cuando están presentes en conjunto en
pacientes atópicos. La aceptación del medicamento es buena, aunque la
sedación podría ser problema en niños mayores y adultos durante el período
inicial del tratamiento (habitualmente las primeras dos semanas). La
ganancia de peso es otro efecto notable en un reducido grupo de pacientes (no
en nuestra serie). Por lo tanto el Ketotifeno parece ser un argumento
terapéutico en el manejo de desórdenes alérgicos y en asma bronquial,
particularmente en aquellos en que la terapia oral es la preferida.
Aunque un largo período de tiempo es necesario para producir la remisión de los
síntomas, en aquellos pacientes que responden, uno puede anticipar una reducción,
mantenida, en la frecuencia y severidad de los mismos y en el uso de drogas
antiasmáticas (44).
Resumen
El descubrimiento del Cromoglicato Disódico representa un importante progreso
en el tratamiento del asma. Sin embargo, debido a su pobre solubilidad e
incapacidad para ser absorbido del tracto gastrointestinal, la forma galénica
de este medicamento es una de sus mayores desventajas relativas en la práctica
clínica. Esto ha estimulado los estudios para encontrar agentes
terapéuticos que sean activos y bien tolerados por vía oral. Un agente es
el Ketotifeno (HC-20-511), el cual está químicamente relacionado al grupo de
sustancias del tipo cicloheptathiopheno. Este producto ha mostrado varias
propiedades farmacológicas en enfermedades alérgicas. Ha demostrado muy
bajo nivel de toxicidad y una rápida y completa absorción a través del tubo
digestivo. Nosotros reportamos la eficacia clínica y la tolerancia del
Ketotifeno en un grupo de pacientes con asma bronquial de leve a moderada. El
análisis estadístico de la información muestra que el uso de Ketotifeno ayuda a
controlar los síntomas del asma y es una droga prometedora en el tratamiento
profiláctico del asma.
Bibliografía
1.
Ambrosi,
L; Bariffi, F,; Carino, M.; Catena, E.; Ceccarelli, G.; Ciampini, M.;
Gondolucci, M.; Crimi, N.; Ferretti, G.; Gambaro, G.; et all. Azelastine in the prophylactic treatment of bronchial asthma: an Italian
multicentre comparison with ketotifen. J. Int. Med. Resp.
1989; 17: 218-225.
2.
Arnous, B.; Deniean, P.; Page, C.P.; Nolibe,
D.; Morley, J.; Benveniste, J. Accululation of platetels and eosinophils in
baboon lung after paf-acether challenge: inhibition o ketotifen. Am.
Rev. Respir. Dis. 1988; 137: 855-860.
3.
As, Van Andre. the accuracy of peak
expiratory flow meters. Chest. 1983; 67: 547-542.
4.
ATS. American Thoracis Society
committee on diagnostic Standar for Non-Tuberculosis Diseases. Definition
and Clasifications of cronic bronchitis, asthma and pulmonary emphysema. Am.
Rev. Respir. Dis. 1962; 85: 762.
5.
Atkin M.F. Use of cromolyn in Asthma. Sem.
Respir. Med. 1987; 8:381-386.
6.
Barnes, J. P. Drug Therapy - A new Approach
to the treatment of Asthma. N. Engl. J. Med. 1989; 321:1517-1527.
7.
Beumer, M.H. Bronchial reactivity in Asthma
to Inhaled Histamine during treatment with ketotiten. Respiration. 1979;
37: 271-277.
8.
Bousquet, J.; Chávez, R; Lacost, J. Y.;
Barcon, G.; Chavanian. N.; Enander, I.; et al. Eosinophilic
Inflamation Asthma. N. Engl. J. Med. 1990; 323: 1033-1039.
9.
Bernstein, I. L. Cromolyn sodiurn. Chest.
1985; 87: 68S-78S.
10.
Bernstein, 1. L; Siegel, S. G.; Brandon, M.
L.; et all. A controlled stydy of cromolyn sodium sponsored by the drug
committe of the American Academy of Allergy. J. Allergy Clin. Immunol.
1972; 50: 235-245.
11.
Broberg,V.;Graff-Lonnevia,V; Lilja,G.;
Rylander, E. Ketotifen in pollen-induced asthma: a double-blind placebo
controlled study. Clin Allergy. 1986; 18: 119-127.
12.
Brithis Thoracic Society, Research Unit of
the Royal College of Physicians of London, King's fund Center, National Asthma
Campaign. Guidlines for the management of Asthma in Adults: l- Chronic
persistent asthma. B.M.J. 1990; 301: 651-653.
13.
Borel, F.J. Effect of ketotifen in Some
Inmunological Animal Models. Respiration. 1980; 19 (Suppl 1): 38-45.
14.
Castillo, J. G.; Gamboa, P. M.; García,
B.E.; Oehling, A. effect of ketotifen on phosphodiesterase activity from
asthmatic individuals. Allergol. Immunopathol. 1990; 18: 197-201.
15.
Castillo, J.G.; Gamboa, P.M.; Santos, E;
Oehling A. Effect of ketotifen on the metyltransferasa activity of asthmatic
patients. Allergol. Immunopathol. 1990; 18: 255-259.
16.
Cirard, P. J.; Cuevas, M. Antiasthmatic
properties of a new peroral drug (HC-20-511). Acta Allergo. 1977; 12:
145-149.
17.
Clauzel, M.; Calvayrac, F.; Michael, B.;
Mcurd, C. Double-blind, double-placebo test of ketotifen and disodium
cromoglycate in the treatment of asthma. Provenc méd. 1980; 48: 78-82.
18.
Clarke, W.C.; May S.G.A.Comparis on of the
efficacy of ketotifen (HC-20-511) with Sodium Cromoglycate (SCG) in skin Test
Positive Asthma. Brit. J. Clin. Pharmacol. 1980; 10: 473-476.
19.
Craps, L.; Greewod, C.; Radielovic, P.
Clinical investigations of agents with prophilactic antiallergic effects in
bronchial asthma. Clin. Allergy. 1978; 8: 373-382.
20.
Craps, L.; Grenwood, C.; Radielovic, P.
Clinical investigation of agents with prophilactic antiallergy effects in
bronchiál asthma. Clin. Allergy. 1978; 8; 373-382.
21.
Crowder, D.; Greenwood, C. Changing the
therapy of stable asthmatic patients. Practicioner. 1979: 223: 398-402.
22.
Coon, 0. H. Endoscopic Sclerotherapy: The
State of the Art. Hosp. Pract. 1987; 22: 9-16.
23.
Cox, G. S. J. Disodium Cromoglyeate
(cromolyn sodium) in Bronchial Asthma. In: Weiss, C.B.; Segal M.S. (Eds):
Bronchial Asthma. Mechanims and therapeutics (Ist. Edition)
Boston. Little Brown and Company. 1976; 805-836.
24.
Cott, G.R.; Cherniak, R.M. Steroids and
"steroid-Sparing" Agents in Asthma N. Engl. J. Med. 1988; 318:
634-636.
25.
Cherniak, M. R. Continuity of care in Asthma
Management. Hosp. Pract. 1987; 15: 119.
26.
Chihara, J.; Kubo, H.; Sakurada, R.;
Yamamoto, J.; Nakano, N.; sugihara, R.; Nakajima, S. IgE-Fc receptor
expressions on bronchoalveolar lavage (BAL) cells in a patient with
eosinophilic pneumonia accompanied with bronchial asthma. The effect of
ketotifen on their expression. Arerugy. 1984; 38: 323-333.
27.
Chusid, E.E.; Chisid, E. L. Ketotifen in the
prophilaxixs of asthma. Chest. 1984; 86: 290.
28.
Chung, F. K.; Minette, Ph.; cusker, M;
Bamer, J.P. Ketotifen inhibits the cutaneous but no the airway responses to
platetel-activing factor in man. J. Allergy Clin. Immunol. 1988;
81: 1197-1198.
29.
Dawson, J.P.; Ferguson, D. M.; Horwood, L.
J.; Mogride, N. Ketotifen in asthma. Aust-PedtiatrJ. 1989; 25: 89-92.
30.
Debelic, M.; Radielovic, R; Wuetrich, B.
Clinical Experimental Models in the Study of Antiobsdtructive drugs. Congress
of The Research Groups on Clinical Respiratory Phisiology-Austrian Society for
Pulmonary disease and Turberculosis. Graz. 1976, pp: 276-283.
31.
Debelic, M.; Wutrich, B. Radielovic, P.
Protective effect of ketotifen in Clinical Experimental Models. Allergolog.
Immunopathol. 1977; (Suppl): 5: 17-20.
32. Dubois de Montieynaud, J.M.; Artigas, C. Ketotifen in basic treatment of asthma. Rey. Franc Allerg. 1979; 19: 101-104.
33.
Eiser,
N.H. Antihistamines. In: Buckel, D.R., Smith A.
Development of anti-asthma drugs. London butterworths. 1984: 121-131.
34.
Fernández, M.; Wong, E.; Oehiing,. A.
retrospective study of ketotifen - protective actionin different allergo.
pathies. Allergolog. Immunopathol. 1987; 15: 369-373.
35.
Fernández, M. A retrospective analysis of
ketotifen. Allergolog. Immunopatholo. 1987; 15 375378.
36.
Findley, J.L.; Sann, A. S. The value of
Chest Reentgenegrams in Acute Asthma in Adults. Chest. 1981- 80: 535-536.
37.
Fleming, M.D.; Crombiel, L.D. Prevalence of
asthma and hay fever in England and Wales. B.M.J. 1987; 294: 279-283.
38.
Ganty, M.; Scoling, D.; Danzigen, Y.;
Volovitz, B.; Ilfedd, N.D.; VRSno. 1. Non-Interaction of ketotifen and
Theophylline in children with Asthma - an Acute Study. Europ. J.
clin. Pharmacol. 1987; 32: 187-189.
39.
Georgitis, W. J. The 1977 Asthma Management
Guidelines and Therapeutic Issues Relating to the Treatment of Asthma. Chest.
1999; 115: 210217.
40. Gobel, P. The Protective Effect of ketotifen in Bronchial Asthma. J. Int. Med. Res. 1978; 6: 79-85.
41.
Guido,
M, I.; Alvarado, G.A. La reacción tardía en asma bronquial. A.M.C. 1991; 34:94-111.
42.
González RI.: Girardi, G. Therapy with
ketotifen in breast-fed infants with asthrna. Bol. Med.
Hosp. Infants. Mex. 1989; 4b: 395-398.
43.
Greenwood, C. MB. The Pharmacology of
Ketotifen Chest. 1982; 82 (Suppl): 455-485.
44.
Grant, S. M.; Goa, K.L.; Fitton, S.; Sorkin,
E.M. Ketotifen. A review of its pharmacodynamic and pharmacokinetc
properties, and therapeutic use in asthma and allergic disorders. Drugs.
1990; 40: 412-448.
45.
Gzirishvill, A. M.; Kavelazde, O. A.,
Gurgendize, V.A.; Shevardnadze, I.T. The protective action of Intal and Zaditen
in Bronchial Asthma. Allergolog. Immunopathol. 1980; 8: 479.
46.
Herbert, A. F.; Salkie, L. M. Rast and Skin
Test screening in the investigation of asthma. Ann. Allergy. 1982;
49: 311-314.
47.
Hoag, E. J.; Mcfadden, J. L. Long-term
effect of cromolyn sodium on nospecific bronchial hyper- responsiveness: a
review Ann. Allergy. 1991; 66: 53-63.
48.
Iikura, Y.; Baba, M.; Mikana, H.; Nishima,
S; Naeda., K.; Akassaka, T.; Arita, M.; Niiya, H.; Koya, N; et al. A
double blind study of the effectiveness of ketotifen in preventing the
development os asthma in atopic dermatitis patients. Arerugi. 1991; 40:
132-140.
49.
Kasuya, S.: Jzumi, S. Steroid-sparing effect
of ketotifen in steroid-dependent asthmatic: a long period evaluation in 12
patients. Pharmaterapeutics. 1988; 5: 177-182.
50.
Karayani, M.; Hadziangurow, D.;
Liapi-Adamidov.; Anagnestakis, I.; Sayoni-Papageorgiou, F. Effect of Ketotifen
on childhood asthma: a double-blind study. J. Asthma. 1990, 87-93.
51.
Kennedy G. R.; SheriffL.; Comparison of the
orally administered anti-allergy agent with sodium cromoglicate in the
prophilaxis of bronchial asthma. Respiration. 1981; 41: 364-369.
52.
Knol, K.; Neyens, I. H. A Multicentre Study
on the Efficacy of Keotifen in Wheezy Infants. Triangle. 1987; 26 (Suppl.
1) pp. 29-34.
53.
Knol, K. Long-term, placebo-controled trial
of keotifen in the management of prescholar children with asthma. J.
Allergy Clin. Immunol. 1988; 82: 483-484.
54.
Koshino, E.T.; Agrawl, D.K.; Townley, R.G.
Effect of ketotifen on the Down Regulation of Beta-adrenoreceptors in
Guinea-Pig lung (L) and Spleen (S). Am. Rey. Respir. Dis.
1988; 137 (Abstrct): 27.
55.
Koya, N.; Moroi, T.; Hana, M.; Suzuki, S.;
Tateng, A.; Nagata, K. The investigation of asthmatic children by multiple
factor analysis. The changes in allergic factors selected by multiple
factor analysis in 3 anti-allergic during treated groups over one year. Arerugy.
1989, 38: 1334-1346.
56.
Konig, P. A. Step-Wise Approach to the
Changing Drug Therapy of Asthrna. Am. J. Asthma Allergy Pediatr. 1992;
5: 69-74.
57.
Kumagai, A.; Tomioka, H.; Shida, T.J.;
Takahashi, T.; Muranka, M. Clinical evaluation of a new orally activid
anti-anaphylacti compound: Ketotifen (HC-2051 1) in Japanese adult
asthmatics. Schweiz. Med. Wseh. 193; 110: 197-203.
58.
Kurosava, M; Kobayashi, S. Investigation of
the effect of Ketotifen on alcohol-induced asthma: a case study. J.
Int. Med. Res. 1990; 18: 435-439.
59.
Kristersson, A.; Morley, J.; Schaeubin, E.
Properities of AH-21-132 that could contribute to prophylactic activity in
asthma. Br. J. Pharmacol. 1988; 31: 997-1020.
60.
Labus, J.; Hiinka, V. The Clinical Effect of
Ketotifen in Bronchial Asthma. J. Int. Med. Res. 1979; 7:
305-313.
61.
Lane, J.D.A. Steroidsparing effect of
Ketotifen in steroid dependent asthmatics. Clin. Allergy. 1980; 10:
519-525.
62.
Lamarre, A.; Vinocke, R; Lapierre, G. J.;
Ackermans, F. Doubled-blind Study Comparing Ketotifen and D.S.C.G. In
Adolescent Asthmatics. Respiration. 1980; 39 (Suppl. 1): 16-17.
63.
Medici, G. T.; Radielovic, P.-, Morley, J.
Ketotifen in the prophylaxis of Extrinsic Bronchial Asthma. A Multicenter
Doubled-Blind Study with a Modified-Release Forrnulation. Chest, 1989;
96: 1252-57.
64.
Lenfant, C. Foreword. J. Allergy Clin.
Immunol. 1991; 88: (Suppl 2) 425.
65.
Rinithis Allergic and Non-allergic. Hosp.
Pract. 1988; 23: 117-145.
66.
Lichtenstein, M. L.; Gille Spie, E. The
effects of the H-1 and H-2 Antihistamines on Allergic Histamine release and its
inhibition by Histamine. J. Pharmacol. Exp. Ther.
1975; 192: 441-450.
67.
Lisboa, C.; Moreno, R.; Cruz, e.; Barja, S.;
Sánchez, L.; Moran, J.; Ferretti, R. Acute effect of ketotifen on the
Doseresponse Curve of Histamine and Metacholina in Asthma. Br. J.
Dis. Chest. 1985; 79: 237-243.
68.
Lottus, G. B. Price, F. J. Long terme
okacebo controlled trial o ketotifen in the managernent of preschool children
with asthma. J. Allergy Clin. Immunol. 1988; 82: 483-484.
69.
Lucchessi, M.; Garnbardella, P.; Fiorucci,
F.; Mancini, A. P. Prophylaxis of bronchial asthma. Clinical study of a
new oral drug. Clinica (Bologna). 1980; 35: 67-69.
70.
Mattson, K.; Poppius, H.; Ahonen, A.;
Haahtela, T.; Hurme, K.; Maasilta, P.; Muitari, A. Comparison of ketotifen,
disodium gromoglicate and placebo in the treatment of Adult Patients with
Extrinsic Asthma. Respiration. 1980; 39 (Suppl 1): 20-23.
71.
Mangussen, H.; Hartmann, V. the
AntiAnaphylactic substance Ketotifen in the Long Term oral Therapy of Bronchial
Asthma. Alleergolog. Immunopathol. 1977 Suppl; 5: 27-32.
72.
Martin, U.; Roemer, D. Ketotifen: A
Histamine Release Inhibitor. Monogr. Allergy. 1977; 12: 145-149.
73.
Mattson, K.; Poppius, H.; Hurme, R.A. a
controlled study on the aniallergic agent on methacholine-induced
bronchoconstriction in asthmatics. Clin. Allergy. 1978; 9: 495-501.
74.
Martin, U.; Romer, D. The Pharmacological
Properties of a new, orally active anti-Anaphylactic Compund: Ketotifen, a
Benzocycloheptathiphene. Arzneimittel-Forsch. 1978; 28: 770-782.
75.
Mac-donald, EG.; an overview of ketotifen. Chest.
1982; 82 (Suppl): 30s-32s.
76.
Mashalla, Y.J.; Maselle, D. Y. Pulmonary
function parameters in asthma patients receving oral ketotifen. East-Afr.
Med-J. 1990; 67; 842-849.
77.
Manthous, A.C. Management of severe
Exacerbations of Asthma. Am: J. Med. 1995; 99: 298308.
78.
Mc. Fadden, P.R.; Linden J.A. Reduction in
maximun mid-expiratory flow-rate: a spirographic manifestation of small airway
disease. Am. J. Med. 1972; 725-727.
79.
Mc Donald, F. G.; Plumley, L.D.; Ackennan. F.
Canadian Clinical study Comparing two Prophylactic Asthma Drugs. Allergolog.
Immunopathol. 1980; 8:477.
80.
Medici, G.T.; Radielovic, R; Morley, J.
Ketotifen in the Prophilaxis of Extrinsic Bronchial Asthma. A Multiconter
Doubled-Blind Study with a modified-Release Formulation. Chest. 1989-,
96: 1252-57.
81.
Morris, J. M.; Lane, J.D. Ketotifen in
Bronchial Asthma. Respiration. 1980; 39 (Suppl): 10li.
82.
Morril. G.C.; Dickey, D.W.; Weisser,
P, C.; Kinsman, R. A.; Chair, H.; Spector, S.L. Calibration and stability of
standar and mini-wright peak flow meters. Ann. Allergy. 1981; 46:
70-73.
83.
Morley, J. Platetel activatng factor and the
search for prophylactic antasthma drugs. In: Jenne, J.W.; Murphy, S.
Eds. Drug therapy of asthma: research and clinical practice. New
York: Marcel Dekkor, Inc. 1987; 31: 997-1020.
84.
Mullarkey, F.M.; Rotumestein, A. B.; Pierre
Andrade, W.; Bailey, A.G.; Olason, J., Wetzel, EC. Methotrexate in the
treatment of corticosteroid-dependent asthma. A Double-Blind Crossover
Study. N. Engl. Med. 1988; 318: 603-607.
85.
National Hearth, Long, and Blood Institute.
National Asthma Education Program. Expert Panel Report. Definition
and diagnosis. J. Allergy Clin. Immunol. 1991: 88 (Suppl 2):
427-438.
86.
Naspitz, K. Ch.; Freirre, A. R. C.
Evaluation of ketotifen in the prophylactic treatment of bronchial asthma in
children. Allergol. Immunopathol. 1988; 16: 27-31.
87.
National Hearth, Lung, and Blood
Institute. National Asthma Education Program. Expert Panel
Report. Asthma Mortality. J. Allergy Clin. Immunol. 1991; 88
(Supl 2): 447-450.
88.
National Hearth, Lung, and Blood
Institute. National Asthma Education Program. Expert Panel
Report. Overview of approaches to asthma therapy. J Allergy
Clin. Immunol. 1991: 88 (Suppl 2): 451459.
89.
Nadel, J.A.; Busee, Ww. Asthma.
Am. J. Respir. Crit. Care Med. 157: pp sl30-sl38; 1998.
90.
National Asthma Education and Prevention
Program. Expert panle reort 2: guidlines for the diagnosis and management
of Asthma. NIH. Publication. Nº 97-405 1. Bethesda.
MD. National Institute of Health. 1997.
91.
Neijens, H.J.; Knol, K. Oral prophylacticd
treatment in wheezy infants. Immunol. – Allergy Practice. 1988; 10:
17-23.
92.
Neffen, H.E. Pharmacoprevention of bronchial
asthma using membrane stablizer and asthma mortality. Rev.
Alerg. Mex. 1990; 37: 155-163.
93.
Noma,
T.; Toshizava, 1: Baba, M.; Yata, l.; Akasaka. T.;
Maeda, K. Effecto of ketotifen on antigen-induced interleukina 2 (IL-2)
responivenees in lymphocytes from patients with dermatitis and or bronchial
asthma. Int. J. Immunopharmaco. 1990; 12: 269-277.
94.
Pauwels, R.; Van Der Straeten M. The effecto
of Ketotifen on bronchial beta-adrenergic tachyphylaxis in normal human
volunteers. J. Allergy Clin. Immunol. 1988; 81: 674-680.
95.
Pertheram, S.I.; Morham, J.; Bierman, W.C.;
Mc. Allen.: Spiro, G.S. Ketotifen in atopic Asthma. Thorax; 1981: 36:
308-312.
96.
Petty, T.L. Rollins, D.R.; Christopher, K.;
Good, J.I.; Oakley, R. Cromolyn sodium is effective in adult chronic
asthmatics. Am Rev Respir. Dis. 1989; 139: 694-701.
97.
Pellegrino, R.; rodarte, J.R.; Brusosco, V.
Assessing the Reversibility of Airway Obstruction. Chest. 1998; 114:
1607-1612.
98.
Phillips, J.M.; Ollier, S.: Davies, J. the
effects of drugs on the inmediate skin reaction produced by allergens and
histamine. Clin. Allergy. 1986; 10: 465.
99.
Phillips, J. M.; Ollier, S.; Davies, J. R.
Use of anterior Rhinometry in Nasal Provocation Challenges with allergen and
Evaluation of the Effects of Ketotifen, Clemastine and sodium Cromoglicate on
the Responses. Respiration. 1980; 39 (Suppl 1): 26-31.
100.
Rackman, A.; Brown, C.A.; Chandra, R.K.; Ho,
P.; Hoogerweel, P.E.; Kennedy, R.J.; Knight, A.; Langer, H.; Milne, J.; Moote,
O.W.
101.
Rees, P.J. Guidelines for the management of
asthma in adults. An excellent firts effort. B.M.J. 1990;
301-771-772.
102. Sabbah, A. Bioclinical Study of Ketotifen in reaginic
Hypersensitivity. Quest. Med. 1980; 33: 389-397.
103.Sarsetel,
K.E Ketotifen and Asthma. Arch. Dis. Childhood. 1981; 56:
243-244.
104. Sears, M.R.; et al. Regular inhaled beta-agonist
treatment in bronchial astyhma. Lancet. 1990; 336:
1391-1396.
105. Simons. R.F.S.; Luciuk, H.G.; Becker, B.A.; Guillespié, D. C.
Ketotifen: a new Drug for Prophylaxis of Asthma in Children. An.
Allergy. 1982; 48: 145-150.
106. Spitzer, 0. W.; Suissa, S. Ernst, P.; Horwithz, I.R.; Cockroft, D.; et
al. The use of B-agonist and the risk of death from asthma. N.
Engl. J. Med. 1992; 326: 501-506.
107. Slapke, j.; Muller, S.; Boerner, d. A. one-year double-blind clinical
study of the efficacy and tolerability of picumast digydrochloride versus
ketotifen in patients with brinchial asthma. Arzneiimittelforschung.
1989; 39: 1368-1372.
108. Stangel, B.; Furlan, J.; Ustar, M.; Janezic, H. The Protective effect of
ketotifen in Bronchial Asthma. Respiration. 1980- 39 (Suppl 1) 12-15.
109. Szceli, A.; Czarniawaska-Mysk, G.; Adamek-Guziek. T.; Wotoszynshi,
J.; Koterba, A. Ketotifen versus sodium cromoglicate in the therapy of allergic
(extrinsic) Bronchial Asthma. Respiration. 1980; 39 (Suppl): 3-9.
110. Tageldin, M.P. Long-term prophylaxis treatment of Occupational
Asthma. E. M. J. 1990-7: 7589.
111. Tan, C.W.; Lim, K.J. Doubled-blind comparison of the protective effect
of sodium cromoglicate and ketotifen on excercise-induced asthma in
adults. Allergy. 1987; 42: 315-317.
112. Taylor, R.; Ford, R. Ketotifen in childhood asthma: a doubled-blind placebo
controlled trial. Clin. Allergy. 1979; 9: 241-243.
113. Tinkelman, D.G.; Moos, B.A.; Bukantz, S.G.; Scheffer, A.L.; Dobken,
J.H.; Chodosh, S. et all. A multicenter trial of the prophylactic effect
of ketotiten, theophylline, and placebo in atopic asthma. J. Allergy
Clin. Immunol. 1985; 76: 487-497.
114. Tomioka, H.; Yoshide, S.; Tanaka, M.; Kumagai, A
Inhibition of Chemical Mediator Release from Human Leucocytes
by a New Antiasthmatic Drug, HC-20-511 (ketotifen). Monogr. Allergy
1979; 14: 313-317.
115. Tossin, L.; Chiesvra-Corona, P.; Fabbri, L.M.; De Marzo, N; Picotti, G.;
Creseioli, S. ketotifen does not inhibity asthmatic reactions induced by
toluene di-isocyanate in sensited subjects. Clin. Exp.
Allergy. 1989; 19: 147-182.
116. Uzar, R.; Herjavecz, J.; Boszormenyi-Nagy; G.; Slapo, l.; Schreiber, J.;
Debrezceni, L.A. Effect of Ketotifen and clenbuterol on betaadrenergic receptor
functions of lymphocytes and on plasma TXB-2 level of asthmatic patients.
Erkr-Atmung-sorgane. 1990; 175: 141-146.
117. Warner, O.J.; Gotz, M.; Landau. I.L.; Levison, H.; Milner, D.A.;
Pederson, S.; Silverman, M. Management of asthma: a consensus statement. Special
report. Arch. Dis. Childhood. 1989; 64: 1065-1079.
118. Wasserman, I.S. Platelet-Activating Factor as a Mediator of Bronchial
Asthma. Hosp. Pract. 1988; 23: 49-58.
119. Wichert, P.V. Ketotifen, an Anti-Allergic Drug:
Pharmacology Figures and Clinical Experience. Clin. Respir.
Phisiology. 1980; 14: 181-185.
120. William, G.C.; Pavuk, J.; Budd, C. Value of immunoglobulin E in the
private practice of Allergy. Eitht years experience. Ann.
Allergy. 1982; 50: 317-319.
121. Wichert, von P. Ketotifen, an Anti-Allergic Drug. Respiration.
1989; 8: 477.
122. Wuethrich, B.; Radielovic, P.; Debelic, M. The protective effect of a
new oral anti-asthma agent (ketotifen, HC 20-511) against experimental induced
bronchospasm (5 different models). Int. J. Pharmacol. 1978; 16:
424-429.
123. Wuethrich, B.; Radielovic, P. Drug prophylaxis of bronchial asthma
inhibition of histamine-and exercise-induced bronchial spasms by a new
anti-anaphylactic oral preparation (ketotifen). Dtsch. med Wschr. 1978;
103: 1865-1869.
124. Wuthrich, B. Protective effect of Ketotifen and Disodium Cromoglicate Against bronchoconstruction Induced by aspirin Benzoic Acid or tatrazine in Intolerant Asthmatics. Respiration 1979; 37: 224-231.
* Mario Ingianna Acuña. Hspital San
Juan de Dios. Apartado 1475-1000, S.J.C.R.
** Laboratorio de Fisiopatología Respiratoria, Unidad de Cuidados
Intensivos Respiratorio. Servicio de Neumología. Hospital San Juan de Dios.
*** Médicos Internistas y Neumólogos.