Summary
The following work on the subject is a review of information about the etiology and inmunopathogenesis, still controversial, of idiopathic pulmonary fibrosis.
To attain knowledge of the etiology, first, an allusion will be made on the roll that different cells, mainly neutrophils and macrophages, play as mediators of pulmonary parenchyma damage through different immunological mechanisms and the roll of chemotactic factors, lymphokines and growth factors will be emphasized.
Besides, based on data found by electronic microscopy, the additional mechanisms responsable of the interstitial thickening: partial or total alveolar collapse and apposition of the alveolar septa, incorporation of intraalveolar exudates into the alveolar septa; will be explained.
Palabras claves:
ETIOLOGÍA
PATOGÉNESIS
FIBROSIS PULMONAR
INTERSTICIAL
SARCOIDOSIS
NEUMONÍA EOSINOFÍLICA
Key words
ETIOLOGY
PATHOGENESIS
INTERSTITIAL PULMONARY
FIBROSIS
SARCOIDOSIS
EOSINOPHILIC PNEUMONIA.
Resumen de Inmunopatogénesis
de Fibrosis Pulmonar:
Macrófagos
Los macrófagos activados
secretan:
- Factores quimiotácticos
para neutrófilos.
- Factores que estimulan
la actividad secretora de fibroblastos y Neutrófilos.
- Proteasas y radicales
tóxicos-de oxígeno e hidroxilos al igual que los neutrófilos.
Mastocitos
Con la ayuda de tinciones
apropiadas se ha visto que estas células son numerosas en el tejido
intersticial y con la ayuda de la microscopia electrónica se ha demostrado
que los mastocitos se encuentran en aposición a los fibroblastos al
igual que las células epiteliales en regeneración, para proporcionar
estimulación adicional.
Linfocitos
La célula predominante
en el intersticio a pacientes con alveolitis fibrosante, es el linfocito,
el cual puede ser T colaborador (T4). como T supresor / citotóxico
(T8). Además, la Il-4 y la IL-5 predominan sugiriendo una
respuesta de tipo TH 2 (3), pese a que en otros estudios
la respuesta THI fue la vinculada con la aparición de inflamación
pulmonar progresiva llevando al paciente a fibrosis pulmonar. (1)
Células epiteliales
alveolares
Las células epiteliales
podrían ser reconocidas como autoantígenos por las células
T citotóxicos al mostrar expresión aberrante del antígeno
HLA-DR. Por otra parte, la proliferación epitelial regenerativa
vista al microscopio de luz como metaplasia cuboidal, común en
todas las etapas de la enfermedad, podría jugar un papel muy importante
en la patogénesis de esta entidad puesto que dicho epitelio libera
endotelina y factores fibrogénicos como el TNF-A y TGF-B.
Además, también se han descrito contactos directos entre
las células epiteliales y elementos del intersticio como los fibroblastos,
a través de deficiencias encontradas a lo largo de la membrana basal,
facilitándose de ésta manera el paso de cualquier mensaje
epitelial al tejido conectivo. La pérdida del epitelio y la
deficiencia de surfactante secundaria, puede ayudar a explicar el colapso
focal de los alveólos con aposición de las membranas basases
denudadas descrita en el síndrome de Hamman-Rich y el daño
alveolar difuso. La regeneración epitelial que cubre los orificios
de los alveólos colapsados, lleva a una pérdida permanente
de los alveólos, proceso de reparación pulmonar conocido como
induración atelectásica. Ocasionalmente, las membranas
basales epiteliales se cubren con fibrina en el daño alveolar difuso,
síndrome de Hamnan-Rich y durante las exacerbaciones de los casos
más crónicos. La incorporación de la fibrina
en el intersticio y su organización es otro proceso por el cual se
puede desarrollar fibrosis intersticial.
El endotelio capilar
El daño endotelial,
el edema intersticial y la fenestración del endotelio que se regenera
se observan en la microscopia electrónica. Dicho daño
endotelial promueve el edema intersticial al tornarse crónico y
contribuye a la fibrosis intersticial (8). La base autoinmune
de la UIP esta mejor establecida que para la DIP. La DIP probablemente
está más relacionada con la bronquiolitis respiratoria asociada
a enfermedad intersticial pulmonar vista en fumadores de cigarrillos y
considerada anteriormente.
Sarcoidosis
Patogénesis
La peculiar reacción
tisular granulomatosa propia de la Sarcoidosis sugiere que debe existir
un antígeno persistente, probablemente escasamente degradable que
inicie el proceso inmnológico activo, que puede resolverse espontáneamente
o progresar a la formación de granulomas, los cuales junto con la
alveolitis pueden causar daño al parénquima pulmonar y llevar
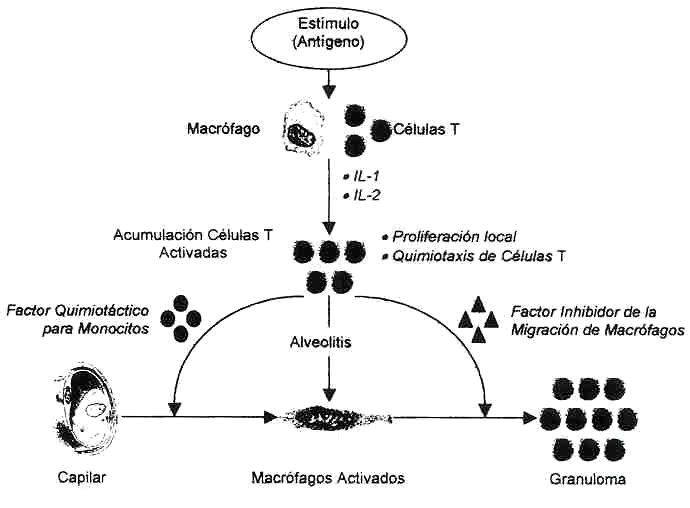
a la fibrosis pulmonar (1), (Fig. 1).
Después del estímulo antígenico se da activación
de los macrófagos locales y de las células T, por lo que van
a secretar IL1 e IL-2 respectivamente. La liberación de estos
mediadores tiene dos objetivos:
a) La estimulación
de la proliferación de células T a nivel local.
b) El reclutamiento de
células T provenientes de la sangre periférica.
El reclutamiento de células T a nivel pulmonar podría explicar la Tlinfopenia usualmente asociada a este desorden, y el probable gradiente de actividad quimiotáctica de monocitos entre el pulmón y la sangre periférico. El papel de las células T en la formación de la reacción granulomatosa es de vital importancia puesto que éstas van a ser las responsables de atraer al pulmón los monocitos provenientes de la sangre periférica a través de la liberación del factor quimiotáctico de monocitos, de la activación de estas células a través de la liberación del interferón -gamma, de la inmovilización de los macrófagos en la zona de la inflamación a través de la liberación del factor inhibitorio de la migración de los macrófagos y de la diferenciación de las células B en células secretoras de inmunoglobulinas (25), (Fig. 2). El macrófago desempeña un papel clave en la inflamación crónica debido a la gran cantidad de sustancias biológicamente activas que puede producir, algunas de las cuales son tóxicas para las células. Los estudios morfológicos de las biopsias de pulmón de macrófagos involucrados especialmente en la formación de granulomas, sugieren que estos están activos porque:
a. Se produce
un incremento en la capacidad de las células para liberar radicales
tóxicos de oxígeno así como enzimas microbicidas.
b. Los macrófagos
alveolares de pacientes con sarcoidosis activa liberan interleukina 1 de
manera espontánea.
c. Los macrófagos
alveolares de pacientes con sarcoidosis tienen una capacidad incrementada
de interactuar con el sistema de coagulación fibrinolítico.
Modulación de la enfermedad en pacientes con sarcoidosis.
Linfocitos T.
El proceso
de formación de granulomas está modulado por la presencia
de linfocitos T (10). Por ejemplo, en modelos animales
se ha demostrado que los linfocitos T colaboradores que tienden a ampliar
las respuestas celulares inmunes predominan en las etapas tempranas o de sarcoidosis
activa mientras que, los linfocitos T supresores que tienen un efecto opuesto
a los anteriores predominan en pacientes con enfermedad inactiva o estable.
Fibrosis
Diversos estudios sugieren
que la IL -1 y el interferón desempeñan un papel importante
en la aparición del proceso fibrótico, puesto que actúan
como factores de crecimiento para fibroblastos y puesto que actúan
de manera sinérgica para incrementar la proliferación de
los mismos. Sin embargo también existen otros factores tales
como la fibronectina y un factor de crecimiento derivado de los macrófagos,
que dan lugar a la proliferación de fibroblastos y al depósito
de colágeno.
Producción
de Inmunoglobulinas
La hipergamaglobulinemia
se encuentra frecuentemente en pacientes con sarcoidosis, lo que sugiere
que probablemente los eventos que llevan a la formación de granulomas
llevan a la producción de inmunoglobulinas. Para esto se requiere
que los macrófagos presenten antígenos a los linfocitos T
y que éstos liberen IL-1. Así, las células T
activadas de esta manera, liberarán una variedad de linfocinas importantes
en la formación de la alveolitis y de los granulomas y linfocinas
adicionales como el factor de crecimiento de células B y el factor
de diferenciación de células B importantes para estimular
la producción de inmunoglobulinas por las células plasmáticas.
(25).
Eosinofilia pulmonar
Conceptos generales
b- Esputo
y LBA
Los conteos de eosinófilos
en el esputo y en el LBA reflejan mejor la eosinofilia tisular que los
conteos de estos en sangre periférico, pero también, los eosinófilos
al igual que los neutrófilos, son lavados más fácilmente
del pulmón que los macrófagos, dando como resultado que los
conteos de los mismos se encuentren elevados en enfermedades como la alveolitis
fibrosante, entidad que raramente está caracterizada por un grado
apreciable de eosinofilia tisular. El valor normal de eosinófilos
en el LBA, usualmente expresado como porcentaje del total de células
recuperadas del pulmón es de menos del 3%. Por otra parte, los
eosinófilos en el esputo son generalmente expresados en términos
cualitativos.
c- Biopsia:
La biopsia es la única
manera de establecer a ciencia cierta el diagnóstico de eosinofilia
tisular, sin embargo, en la práctica común, las características
del cuadro clínico, los hallazgos en el hemograma, esputo y LBA
(difícil de evaluar en nuestro medio), son suficientes para establecer
el diagnóstico. En caso de ser necesaria la biopsia, bastará
con realizar una biopsia, transbronquial puesto que en las eosinofilias
pulmonares las áreas de pulmón involucradas en el proceso
son lo suficientemente grandes para ser abordadas con éxito por el
broncoscopista. Sin embargo, algunas eosinofilias pulmonares, caracterizados
por la presencia de vasculitis, se hacen acreedores a una biopsia por toracoscopia,
debido a que las vasculitis raramente pueden ser diagnosticadas por medio
de una biopsia transbronquial por problemas de tamaño de la muestra
(18).
Resumen
Bibliografía
* Médico Interno. Escuela de
Medicina. Universidad de Costa Rica . HOSPITAL SAN JUAN DE DIOS.
2001
** Internista y Neumólogo. Laboratorio de
Fisiopatología Respiratoria. Servicio de Neumología.
HOSPITAL SAN JUAN DE DIOS. SAN JOSE. COSTA RICA. Member
of American Association for Respiratory Care. U.S.A .