SUMMARY
Cystic neoplasms of the pancreas make up a group of uncommon tumors. Their relevance lies upon their favorable prognosis after resection and the fact of being commonly mistaken with pseudocysts. Based on one patient treated at our hospital we make an update review of the literatura on these tumors. To note the role that imaging and puncture-aspiration techniques can play for diagnosis. We conclude that when a cystic lesion of the pancreas is found, the diagnosis of cystic neoplasm must be considered, thus avoiding delays in surgical resections which may worsen the patient's prognosis.
KEY WORDS: Cystadenoma, cystadenocarcinoma, cystic neoplasm of the pancreas, pseudocyst.
INTRODUCCIÓN
Las lesiones quisticas del
páncreas pueden clasificarse en los siguientes grupos (5,18,29)
:
1.Pseudoquistes: representan
colecciones encapsuladas por una pared fibrosa de las secreciones exocrinas
del páncreas extravasadas después de la ruptura de los conductos
pancreáticos por causas inflamatorias (pancreatitis) o traumáticas
(29) constituyen las lesiones quisticas más frecuente
del páncreas (85 %), tienen una comunicación directa con
el sistema de conductos pancreáticos, siendo esta ultima característica
de vital importancia para comprender la evolución natural de los
pseudoquistes pancreáticos y para planear las conductas terapéuticas.
2.Neoplasias quisticas del
páncreas (NQP): Constituyen un grupo patológicamente heterogéneo
de tumores que se originan en el epitelio que tapiza a los conductos pancreáticos,
ocupando el segundo lugar en frecuencia (10-15%) entre las lesiones quisticas
del páncreas (5,29) . A pesar
que solo representan el 1% de todas las neoplasias pancreáticas,
ocupan un lugar muy importante dentro de la patología quirúrgica
del páncreas por su alta tasa de curaciones y sobre todo porque
con frecuencia se confunden con los mas frecuentes pseudoquistes pancreáticos,
lo que ha dado lugar a un elevado porcentaje de tratamientos inadecuados
(observación, marsupialización drenaje interno) (4,5,7,20,24,25,27).
La disponibilidad creciente del ultrasonido y de la tomografía axial
computarizada (TAC) están haciendo que estas lesiones sean detectadas
con mayor frecuencia en la actualidad, lo que hace suponer a muchos que
las cifras anteriormente citadas sean mucho más altas (7,10,24).
3.Misceláneos: Se
cuentan en este grupo los quistes parasitarios (Tenia solium y Equinococo
granuloso) y a los quistes congénitos tanto simples como a los que
se asocian con trastornos hereditarios como la enfermedad poliquistica
del riñón y la enfermedad de von Hippel-Lindau (29).
CASO CLÍNICO
Paciente femenina de 35 años
de edad, vecina de Cahuita (zona rural de Limón), ama de casa. Historia
de masa abdominal de crecimiento progresivo de un año y medio de
evolución, sin dolor abdominal ni perdida de peso, sin antecedentes
patológicos de interés, no ingesta etílica. Al examen
físico se detecta la presencia de tumor abdominal fijo e indoloro
localizado en cuadrante superior izquierdo de abdomen, de mas o menos 15
cm de diámetro (Fig. 1). Hemoleucograma, amilasemia,
proteínas totales y fraccionadas, electrolitos, pruebas de función
renal y hepáticas todas dentro de limites normales. Se le realiza
Ultrasonido de abdomen superior en donde se detecta "masa anecoica, bien
delimitada, sin poder medir el diámetro y la cual parece originarse
en cuerpo del páncreas, con impresión clínica de Pseudoquiste
gigante de páncreas". TAC de abdomen con medio de contraste intravenoso
y oral "masa de 12 x 18 cm a expensas de cuerpo y cola de páncreas,
con cápsula gruesa que toma el contraste en forma intensa y un contenido
de bajo coeficiente de atenuación, con tabique cerca de su contorno
izquierdo que le confiere un aspecto bilobulado a la lesión, lo
cual es compatible con un Pseudoquiste gigante de cuerpo y cola de páncreas,
no se observan adenopatías ni otra alteraciones en abdomen, se realiza
impresión diagnostica de Pseudoquiste gigante de páncreas"
(Fig. 2). Con este diagnostico la paciente se lleva
a sala de operaciones en donde se evidencia un tumor bien circunscrito,
con epiplón adherido (Fig. 3) y se le realiza
pancreatectomia distal con esplenectomia y resección completa de
toda la lesión tumoral (Fig. 4), además
de apendicectomia profiláctico se sutura en dos planos páncreas
distal (Fig. 5) y se cubre con epiplón. No
se realiza drenaje del lecho pancreático (Fig.
6) inicia dieta liquida en postoperatorio inmediato y se egresa al
tercer día postoperatorio en buen estado general y tolerando dieta
corriente. Presenta como complicación pequeño seroma de herida
quirúrgica. Ultimo control clínico a los 53 días de
la cirugía encontrándose en buen estado general ya para esta
fecha se recibe el reporte de patología "masa de 20 x l4 x l0 cm,
al corte multiloculada, teniendo la cavidad mas grande un diámetro
de 12 cm, con material mucoso en su interior (Fig. 7-8),
microscópicamente la lesión esta constituida por una cavidad
quística con pared fibrosa y revestimiento epitelial cilíndrico
estratificado (Fig. 9-10), el borde de resección
pancreático muestra atrofia y fibrosis focales" se hace el diagnostico
de tumor quístico mucinoso del páncreas.
DISCUSIÓN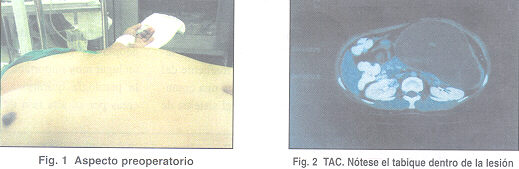
La primera descripción
de una NQP fue realizada por Gross en 1829 (20) y desde
entonces sus características clínicas y su clasificación
fueron confusas por casi mas de un siglo. Gracias a los trabajos que en
1978 publicaran Compagno y Oertel, por un lado (2,3)
y Hodgkinson por el otro (9,10) la clasificación
de los tumores quísticos de páncreas en serosos y mucinosos
fue universalmente reconocida, considerándose los primeros benignos
y los segundos malignos o potencialmente malignos. En el cuadro No 1 se
muestran los diferentes tumores que integran este grupo.
| Neoplasias quisticas mucinosas*
Cistadenoma seroso* Ectasia ductal muninosa* Linfangioma Hemangioma |
Cistadenocarcinoma acinar
Tumor quistico papilar Teratoma quistico Tumor quistico de celulas insulares Paraganglioma |
Neoplasias quísticas mucinosas*Estos tumores son los mas frecuentes.
Las Neoplaslas quísticas mucinosas (NQM) se originan del epitelio ductal (2,9,17,18) aunque hay autores que remontan su origen a una célula stem endodérmica. Desde la aparición del informe de Compagno y Oertel (2) en 1978, se ha reconocido en general que las neoplasias quísticas mucinosas abarcan un espectro que varia entre las lesiones benignas (Cistadenoma mucinoso) hasta las francamente malignas (Cistadenocarcinoma mucinoso). Macroscópicamente son masas lobuladas, redondeadas, bien delimitadas, de superficie lisa y brillante y con una gruesa pared fibrosa (2,7,17,18,29). Al corte son multiloculares, cada una de estas cavidades por lo general mide mas de 2 cm y están llenas de un material denso, rico en mucina, o de líquido hemorrágico o restos necróticos (2,9,10,27). El tamaño de estas lesiones varia entre 2 y 26 cm de diámetro, siendo en promedio de 8 a 10 cm; los cistoadenocarcinomas tienden a ser mas voluminosos que los cistadenomas y en un 66% se localizan en el cuerpo o la cola del páncreas. Microscópicamente están revestidos por un epitelio cilíndrico, siendo la morfología de este la clave para el diagnóstico de benignidad o malignidad; los tumores benignos (cistoadenomas mucinosos) muestran una sola capa de epitelio mientras que los tumores limítrofes o claramente malignos (cistoadenocarcinomas) presentan pseudoestratificación, mitosis y atipias citologicas (2,18,27). En los cistoadenocarcinomas es típico encontrar en la misma lesión tanto epitelio maligno como benigno, incluso hasta en sus metástasis (2,7,29) por lo tanto no es de extrañar que el cistadenocarcinoma pueda tener un solo foco de epitelio maligno invasor con el resto de sus partes de aspecto benigno o puede estar constituido casi exclusivamente por epitelio maligno. Otra característica histológica de las NQM es la discontinuidad del epitelio. Warshaw y colaboradores (25) encontraron zonas desprovistas de epitelio en 72% de estas lesiones, incluso las áreas desprovista de epitelio pueden alcanzar hasta el 98% de la superficie tumoral. Por todos estos motivos y a causa de la dificultad para asegurar un muestreo histológico completo, parece mejor considerar la totalidad de estos tumores como NQM y reconocer que quizá en su mayor parte evolucionaran hasta la conducta maligna si se dejan sin tratamiento. Existen ejemplos comprobados de NQM que quedan latentes durante muchos años y que en un momento dado, adquieren comportamiento maligno con evolución acelerada (2,3). La expresión del factor de crecimiento epidérmico parece desempeñar un papel importante en el desarrollo del potencial maligno de estas lesiones (13).
Cistoadenoma seroso
A diferencia de las NQM que se localizan preferencialmente en cuerpo y cola, el cistadenoma seroso tiende a ubicarse en la cabeza del páncreas (5,7,20,29). Maeroscópicamente son tumores bien circunscritos, de aspecto nodular, mostrando al corte un aspecto en «panal de abeja» al estar formados frecuentemente por numerosos quistes pequeños llenos de un líquido claro y cuyo diámetro varía entre 0,1 y 2 cm (3,18,19,24,27) . Esta estructura les ha dado el nombre de adenomas microquísticos, pero también pueden ser uniloculares y macroquísticos (14) . Los espacios quísticos,estan divididos por septos fibrosos que en ocasiones confluyen en el centro formando una cicatriz estelar (3,4,27). El aspecto microscópico es muy característico y consiste en gran numero de espacios quísticos revestidos por epitelio cuboideo los cuales se encuentran divididos por tabiques fibrosos semejando la estructura alveolar del pulmón (7), las células epiteliales son ricas en glucógeno (3,4,18,27) (de ahí que también se les llame cistoadenomas ricos en glucogeno) y recubren la superficie del quiste de manera uniforme, sin que habitualmente se observen papilas hacia el interior de la cavidad como ocurre en las neoplasias mucinosas (3,18), no muestran atipias ni actividad mitótica (3,4). Los estudios inmunohistoquímicos y de microscopio electrónica sugieren que los cistoadenomas serosos se originan en la célula centroacinar, lo cual explicaría su localización periférico en el parénquima pancreático (3,18). Aunque clásicamente se les ha considerado benignos, en los últimos años se han publicado casos de tumores quísticos serosos con un inesperado comportamiento maligno, mostrando atipias, infiltración local y metástasis a distancia (8).
Ectasia ductal mucinosa
Esta lesión fue descrita inicialmente por Ohashi y colaboradores en 1982,como un tumor intraductal productor de mucina. Se caracteriza por dilatación y llenado del conducto pancreático principal o de sus ramas laterales, por moco viscoso y denso que al obstruir los conductos originan pancreatitis aguda recurrente o síntomas que dan la impresión de pancreatitis crónica (6,7). La ectasia ductal mucinosa (EDM) afecta mas a menudo la cabeza del páncreas, con dilatación del sistema ductal distal y atrofia consecuente de los acinos pancreáticos. Desde el punto de vista histológico el epitelio cilíndrico hiperplásico del conducto (que es el causante de la sobreproducción de moco), forma estructuras papilares que se proyectan a la luz del conducto y de manera característica el tumor crece a lo largo del conducto antes de invadir el parénquima (7). Algunos autores proponen que esta lesión es solo una variante de las NQM ya que ambas producen mucina,siendo que la EDM afecta el conducto pancreático principal y la NQM afecta los conductos periféricos, sin embargo como veremos mas adelante en la presentación clínica de estas entidades, las NQM afectan predominantemente mujeres jóvenes y se localizan en páncreas distal, mientras que la EDM afecta hombres mayores y se localiza con mayor frecuencia en la cabeza del páncreas, sin embargo es inevitable cierta sobreposición.
Presentación clinica
Las NQP predominan en mujeres, con proporciones que varían entre 2 a 1 y 9 a 1 según las series (2,3,5,7,18,24). La edad de presentación tiende a ser menor en las neoplasias mucinosas ocurriendo el 50% entre los 40 y 60 años (2,3,7,29) y siendo la edad media de presentación en las mujeres entre 12 a 25 años antes que los varones (2,5,7). Las formas serosas predominan en edades más avanzadas, presentándose el 80% por encima de los 60 años (3,29). La ectasia ductal mucinosa tiende a presentarse en varones ancianos (7). El tamaño varía para las dos estirpes tumorales entre 1 y 26 cm, con diámetros medios entre 7 y 10 cm (2-4,9,10,12,19,24). En cuanto a su localización, el cistoadenoma seroso afecta a la cabeza del páncreas en el 50% de los casos (3,4,19), mientras que las dos terceras partes de las neoplasias quísticas mucinosas asientan en cuerpo o cola (2,12). La EDM se localiza en la cabeza del páncreas (7). Los síntomas son habitualmente los mismos, estemos ante un tumor mucinoso o seroso (2,3,5,27). En ocasiones están presentes durante años y suelen ser el resultado de la presión ejercida por el tumor sobre órganos vecinos. Además del dolor abdominal, (síntoma más frecuente), pueden también estar presentes náuseas, vómitos, llenura postprandial y pérdida de peso (2-4,10,24). Otras veces es la presencia de una masa abdominal palpable, (signo más frecuente), lo que lleva al paciente a la consulta. La ictericia es rara, elevándose su incidencia en los cistoadenocarcinomas (4,9,22,24).También pueden comenzar como un abdomen agudo, bien sea por oclusión intestinal, rotura quística, hemorragia o absceso (5,29). Cada vez con más frecuencia se descubren casos asintomáticos (19,24); en la serie de Warshaw (24), la más numerosa, el 39% de los tumores benignos no presentaban síntomas.
DIAGNÓSTICO
El ultrasonido y la TAC son
los principales exámenes diagnósticos de las NQP (11,12,16,24).
La TAC, además de mostrar el carácter quístico de
la lesión, nos dará una detallada información sobre
el órgano de origen y las estructuras vecinas . La presencia de
tabiques intraquísticos y/o de un componente sólido, intensificados
tras la administración de contraste, son hallazgos fiables de neoplasia
(12,24,25) y descartarán
a los seudoquistes. Las calcificaciones son frecuentes en las NQP (12,16,27)
y especialmente en las formas serosas (12,29),
pero nunca estarán presentes en la pared de un seudoquiste.
La TAC no sólo es
útil en el diagnóstico diferencial entre seudoquistes y NQP,
sino que también brinda criterios que permiten distinguir entre
los distintos tipos de éstas.Así, una calcificación
central radiada, en «sol naciente», es característica
del cistoadenoma seroso (3,12),mientras
que la calcificación periférico de la pared, arqueada o totalmente
circular, orienta a formas malignas aunque no es específica de ellas.
El cuadro
2 resume las características distintivas entre los pseudoquistes
y las NQP (24,29).
Johnson et al (12),
revisando la TAC de 35 NQP, establecieron una serie de criterios para distinguir
los tumores serosos de los mucinosos: a) más de seis quistes, siendo
la mayoría de ellos menores de 2 cm, y la presencia de una cicatriz
central son hallazgos sugestivos de un cistadenoma seroso; b) menos de
seis quistes, siendo la mayoría de ellos mayores de 2 cm, y la ausencia
de una cicatriz central sugieren un tumor quístico mucinoso, y c)
si al punto b se le suma la evidencia de infiltración local o metástasis
a distancia, el diagnóstico será cistoadenocarcinoma. Con
estos criterios Johnson et al diferenciaron correctamente la estirpe tumoral
en más del 90% de sus casos; sin embargo, Iselin et al (11)
sólo diagnosticaron con acierto las dos terceras partes de los suyos.
La resonancia magnética define mejor que la TAC las características
del contenido quistico; sin embargo, se ve limitada a la hora de demostrar
septos y calcificaciones (16). La colangiopancreatografía
retrógrada endoscópiea (CPR) puede ser utilizada en el diagnóstico
de las NQP, pero habitualmente será normal o aportará sólo
datos inespecíficos como estenosis del conducto pancreático
o amputación en llos casos malignos (4,24).
Donde sí se muestra útil es en el diagnóstico diferencial
con los seudoquistes, pues mientras éstos se comunican con el conducto
pancreático en un 70% de los casos (25,29),
las NQP son habitualmente independientes. En la literatura revisada sólo
hemos encontrado tres casos en que se haya demostrado comunicación
entre una NQP y el conducto pancreático (15,24).
Clásicamente se ha considerado que los cistadenomas serosos y las
neoplasias quísticas mucinosas tienen un patrón angiografico
diferente, reflejo de su diferente estructura histológica (3).
Así, los cistadenomas serosos mostrarían un patrón
hipervascular, en "panal de abeja" reflejando la rica vascularización
de sus múltiples y finos tabiques, mientras que los tumores mucinosos,
habitualmente con pocos o ningún septo, y en los que predominan,
por tanto, los grandes espacios quisticos, mostrarían hipovascularización,
que paralelamente es la regla en los seudoquistes (4,25). Otros autores
en cambio no han corroborado estos hallazgos y así, por ejemplo,
en la serie de Warshaw (24) el 40% de los cistoadenomas
serosos fueron hipovasculares, mientras que el 33% de los cistoadenocarcinomas
mostraron hipervascularización.
| CARACTERISTICA
EDAD SEXO ANTECEDENTES CLINICOS TAC CPR AMILASA SERICA AMILASA LIQUIDO QUISTICO |
NQP
>50 años Mujeres>Hombres Ninguno Múltiples quistes Normal Normal Normal |
PSEUDOQUISTES
>50 años Hombres>Mujeres Pancreatitis, trauma abdominal Quiste unico Comunicación ductal Aumentada Aumentada |
Varios trabajos han valorado en los últimos años la utilidad del análisis del líquido quístico en el diagnóstico diferencial de las neoplasias quísticas y entre éstas y los seudoquistes (1,15,21,23,28). Los parámetros utilizados han sido diversos y algunos de ellos se han mostrado de gran utilidad. En el trabajo de Lewandrowski (15) valores de antígeno carcinoembrionario (CEA) en el aspirado quístico superiores a 24,7 ng/ml mostraron una sensibilidad y especificidad del 100% para el diagnóstico de una neoplasia quística mucinosa. En el mismo trabajo, Lewandrowski concluyó que la viscosidad relativa del fluído quístico distingue la mayoría de tumores mucinosos de los no mucinosos y seudoquistes cuando se encuentran valores superiores a 1,63 ( 89% de sensibilidad, 100% de especificidad ). En el estudio de Alles (1), niveles de CEA 72-4 en el fluído quístico superiores a 150 U/ml mostraron una sensibilidad y especificidad del 100% para el diagnóstico de cistoadenocarcinoma y Rubin (21) encontró que valores de CA 15,3 mayores de 30 U/ml eran muy sugestivos de cistoadenocarcinoma, aunque algunos seudoquistes podían superar esta cifra. La determinación de CA 125 (15) y de antígeno polipeptídico tisular (28) también puede ser de utilidad, mostrando ambos parámetros niveles significativamente más altos en cistoadenocarcinomas que en tumores quísticos benignos y seudoquistes. Al revés ocurre con la elastasa 1, cuyos niveles en el fluído quístico de cistoadenocarcinomas es significativamente menor que en el resto de lesiones quísticas (23). Aunque usualmente altas en seudoquistes, ni la amilasa ni la lipasa discriminan entre los diferentes tipos de lesiones quísticas, aunque valores bajos sugieren el diagnóstico de neoplasia (15). Por último, el estudio citológico del aspirado quístico puede identificar células epiteliales malignas y diagnosticar así algunos casos de cistoadenocarcinoma, pero el fluído puede no contener células exfoliadas o ser éstas benignas si la malignidad es focal (15,21). A pesar de todos los datos hasta aquí consignados, el diagnóstico diferencial de una lesión quística de páncreas puede no realizarse sino hasta el momento de la laparotomía. En ésta, una lesión bien circunscrita, de superficie lisa y brillante, no adherida a vísceras vecinas y rodeada de páncreas normal orientará al cirujano hacia el diagnóstico de neoplasia (4,5,18,25), más aún si en la historia del paciente no hay antecedentes de pancreatitis o traumatismo pancreático. La biopsia por congelación de la pared de la lesión hace el diagnóstico de una neoplasia quística si se demuestra epitelio (24,25), pero la ausencia de éste no descarta la neoplasia pues hasta el 40% de los cistoadenomas serosos y el 72% de los tumores quísticos mucinosos presentan zonas con ausencia de epitelio y la zona denudada puede llegar al 98% de la superficie interna del tumor (24).
TRATAMIENTO
El tratamiento debe ser siempre quirúrgico, con resección completa del tumor. El intento de cirugía curativa no se debe abandonar por el tamaño tumoral, reacción desmoplástica circundante ni por cirugías erróneas previas (4,5,7,25,29). Sólo en pacientes de edad avanzada, de muy alto riesgo quirúrgico, asintomáticos y con diagnostico presuntivo de cistoadenoma seroso, puede plantearse la actitud expectante. La técnica quirúrgica variará según la localización del tumor, así: pancreatoduodenectomía (operación de Whipple) cuando el tumor se localiza en la cabeza y pancreatectomia distal con esplenectomía cuando se sitúa en cuerpo o cola. En algunos casos puede ser necesaria la pancreatectomía total. La enucleación no es una técnica apropiada tanto por su morbimortalidad (19) como por no asegurar un margen de tejido sano en un tumor potencialmente maligno. La resección del tumor consigue la curación en todos los casos benignos y en un alto porcentaje de los malignos, con tasas de supervivencia a los cinco años para estos últimos en torno al 70%. Se han descrito buenos resultados tras la resección de metástasis, por lo que si existen y están localizadas deben extirparse . En los casos en que el tumor es irresecable el pronóstico a corto plazo es desalentador sobreviniendo la muerte en un par de meses (24) , aunque se han descrito sobrevidas prolongadas (2). La experiencia con quimioterapia o radioterapia es limitada, aunque se han comunicado casos de cistoadenocarcinomas irresecables que tras tratamiento con 5 fluorouracilo y radioterapia disminuyeron su tamaño, pudiendo ser posteriormente extirpados (26).
RESUMEN
Las neoplasias quísticas
del páncreas son un grupo de tumores poco comunes cuya importancia
radica en su buen pronóstico tras la resección y en su frecuente
confusión con los pseudoquistes. Basados en un caso tratado en nuestro
hospital realizamos una revisión actualizada de estos tumores, destacando
el papel que pueden desempeñar en su diagnóstico las técnicas
de imagen y la punciónaspiración. Se concluye finalmente
la necesidad de considerar ante toda lesión quística del
páncreas el diagnóstico de neoplasia quística, evitando
así demoras en el tratamiento quirúrgico que puedan empeorar
el pronóstico del paciente.
PALABRAS CLAVE: cistoadenoma,
cistoadenocarcinoma, neoplasias quísticas de páncreas, seudoquiste.
BIBLIOGRAFÍA
1. Alles AJ. Warshaw AL, Southem JF, et al. Expression of CA 72-4 (TAG-72) in the fluid contents of pancreatic cysts. A new marker to distinguish malignant pancreatic cysts tumors from benign neoplasms and pseudocysts. Ann Surg 1994; 219:131-134.
2. Compagno
J, Oertel JE. Mucinous cystic neoplasms of the pancreas with overt and
latent malignancy
(cystadenocarcinoma and cystadeiloma). A clinicopathologic study of 41cases.
Am J Clin Pathol 1978; 69:573-580.
3. Compagno J, Oertel JE. Microcystic adenomas of the pancreas (glycoenrich eystadenoma). A clinicopathologic study of 34 cases. Am J Clin Pathol 1978; 69:289-298.
4. Delcore
R, Thomas JH, Forster J, Hermreck AS. Characteristics of cystic neoplasms
of the pancreas and results of
aggressive surgical treatment. Am J Surg 1992; 164:437-442.
5. Díaz de Liaño A, Aizcorbe Garralda M et al. Neoplasias quísticas de páncreas: revisión de la literatura a propósito de cinco casos. Rev Clín Esp 1999; 199:288-293.
6. Eloubeidi AM, Hawes RH Mucinous tumors of the exocrine páncreas: JMCC 2000; 7:445-451.
7. Fernández-del Castillo C, Warshaw AL.Tumores quisticos del páncreas. Clínicas quirúrgicas de Norteamérica 1995; 5:973-9.
8 . George
DH, Murphy F, Michalski R, et al. Serous cystadenocarcinoma of the pancreas:
a new entity? Am J Surg
Pathol 1989; 13:61-66.
9. Hodgkinson DJ, ReMine WH, Weiland LH. A clinicopathologic study of 21 cases of pancreatic cystadenocarcinoma. Ann Surg 1978; 188:679-684.
10. Hodgkinson DJ, ReMine WH, Weiland LH. Pancreatic cystadenoma A clinicopathologic study of 45 cases. Arch Surg 1978; 113:512-519.
11. Iselin
CE Meyer P, Hauser H,et al. A Computed tomography and fineneedie aspiration
citology for preoperative
evaluaton of cystic tumours of the pancreas. Br J Surg 1993; 80: 1166-1169.
12. Johnson CD, Stephens DH, Charboneau JW, et al. Cystic pancreatic tumors: CT and sonographic assessment. AJR 1988; 151:1133-1138.
13. Kirby
RE, Lewandrowski KB, Southem JF, et al. Relation of epidermal growth factor
receptor and estrogen
receptor-independent pS2 protein to the malignant transformation of mucinous
cystic neoplasms of the pancreas. Arch Surg 1995; 130:69-72.
14. Lewandrowski K, Warshaw A, Compton C. Macrocystic serous cystadenoma of the pancreas: a morphologic variant differing from rnicrocystic adenoma. Hum Pathol 1992; 23:871-875.
15. Lewandrowski KB, Southern JF, Pins MR, et al. Cystic fluid analysis in the differential diagnosis of pancreatic eysts. A comparison of pseudocysts, serous cystadenomas, mucinous cystic neoplasms and mucinous cystadenocarcinoma. Ann Surg 1993; 217:41-47.
16. MinanI M, Itai Y, Ohtomo K, et al. Cystic neoplasms of the pancreas: comparison of MR imaging with CT. Radiology 1989; 171:53-56.
17. Navarro Piñero A, Del Rey Moreno A, Hemández Carmona J, et al. Neoplasias quísticas mucinosas del páncreas. Cir Esp 1996; 59:441-443.
18. Parrilla Paricio P, Sánchez Bueno F, Alcaraz Lorente P, et al. Cistoadenocarcinomas pancreáticos. Presentación de cinco casos. Cir Esp 1987; 41:484-491.
19. Pyke CM, Van Heerden JA, Colby TV, et al. The spectrum of serous cystadenoma of the páncreas. Clinical, pathologic and surgical aspects. Ann Surg 1992; 215:132-139.
20. Romero Cagigal I, Ruiz de Adana JC. Sánchez-Urdazpal L, et al. Neoplasias quísticas pancreáticas: cistoadenoma seroso y cistoadenocarcinoma. Cir Esp 1989; 46:439-443.
21. Rubin D, Warshaw AL, Southern JF, et al. Expression of CA 15.3 protein in the cyst contents distinguishes henign from malignant pancreatic mucinous cystic neoplasms. Surgery 1994; 115:52-55.
22. Talamini MA, Pitt HA, Hruban RH, et al., Spectrum of cystic tumors of the pancreas. Am J Surg 1992; 163:117-124.
23. Tatsuda M, lishi H, Ichii M, et al. Values of carcinoembrionic antigen, elastase 1, and carbohydrate antigen determinant in aspirated pancreatic cystic fluid in the diagnosis of eysts of the pancreas. Cancer 1986; 57: 1836-1839.
24. Warshaw
AL, Compton CC, Lewandrowski K, et al. Cystic tumors of the páncreas.
New clinical, radiologic and
pathologic observations in 67 patients. Ann Surg 1990; 212:432-445.
25. Warshaw AL, Rutledge PL. Cystic tumors mistaken for pancreatic pseudocysts. Ann Surg 1987; 205:393-398.
26. Wood
D, Silbennan AW, Heifetz L, et al. Cystadenocarcinoma of the pancreas:
neo-adjuvant therapy and CEA
monitoring. J Surg Oncol 1990; 43:56-60.
27. Yamaguchi K, Enjoji M. Cystic neoplasms of the pancreas. Gastroenterology 1987; 92:1.934-1.943.
28. Yang JM, Southern JF, Warshaw AL, et al. Proliferation tissue polypeptide antigen distinguishes malignant mucinous cystadenocarcinomas from benign cystic turnors and pseudocysts. Am J Surg 1996; 171:126-129.
29. Yeo CJ, Sarr MG. Cistic and pseudocystic diseases of the pancreas. Curr Probl Surg, March 1994.
*
Especialista de Cirugía General; Hospital Tony Facio Castro; Limón,
Costa Rica
**
Especialista de Anatomía Patológica; Hospital Tony Facio
Castro; Limón, Costa Rica