SUMMARY
The stability of human plasma cholinesterase and acetylcholinesterase activity at room temperature, 4 °C and freezing (-20 °C), over a period of three months is evaluated. lt was found that plasma cholinesterase is stable in refrigeration and freezing over this period. However, at room temperatura the activity of this enzyme Recreases significantly after one week. On the other hand, acetylcholinesterase was stable only stored at +4 °C over the period of evaluation. Freezing-thawing process decreases the activity of the enzyme. Samples stored over one day at -20 °C lose between 10 and 20 % of their activity. At room temperature, the acetylcholinesterase enzyme loses its activity significantly after one week of storage.
Key words: plasma cholinesterase, erythrocyte acetylcholinesterase, plaguicides, organophosphates, carbamates, toxicology.
INTRODUCCIÓN
Dentro del grupo de las colinesterasas se incluyen la acetilcolinesterasa (E.C.3.1.1.7, "colinesterasa verdadera") y la butirilcolinesterasa (E.C.3.1.1.8, "pseudo colinesterasa") (7, 12). La colinesterasa "verdadera" o eritrocítica (AcolE) se encuentra en eritrocitos, terminaciones nerviosas y en la materia gris del cerebro. La "pseudo-colinesterasa" o colinesterasa plasmática (ColP) se encuentra en hígado, páncreas, corazón, materia blanca del cerebro y en plasma (7, 8, 12). La ColP pertenece a un grupo de isoenzimas hepáticas con masa molecular de aproximadamente 300000 Da (12). A pesar de su amplia distribución en tejidos humanos y animales, su función fisiológica aún no se conoce claramente. Algunos sugieren que juega un papel importante en el metabolismo de lípidos y lipoproteínas, regulando la concentración de la colina en plasma o evitando la acumulación de butirilcolina, con sus efectos nicotínicos, durante el metabolismo de ácidos grasos y lipogénesis (7). El análisis de su actividad es de importancia clínica para detectar pacientes con intoxicación por plaguicidas organofosforados y carbamatos, identificar pacientes con formas atípicas con sensibilidad aumentada hacia el anestésico succinilcolina y también puede ser utilizada en el diagnóstico de desórdenes hepáticos (12, 16). Aunque se señala que la actividad de la colinesterasa es un marcador de metabolismo lipídico anormal, tal como hiperlipoproteinemia, obesidad y diabetes mellitus (7), esto no ha sido totalmente comprobado (12). Por su parte, la AColE es una glicoproteína extracelular que se sintetiza primero en el retículo endoplámico y luego es transportada a la superficie celular a través del aparato de Golgi. Tiene un peso molecular de aproximadamente 80,000 Da, aunque las estimaciones varían, según las fuentes y el método (9, 16). Esta enzima es un componente importante de la transmisión colinérgica, que permite un control preciso del tiempo que dura la activación sináptica, hidrolizando rápidamente al neurotransmisor acetilcolina. Después de que la de AColE hidroliza la acetilcolina, termina la transmisión química sináptica. La determinación de AColE se ha empleado principalmente para la detección de la sobreexposición a organofosforados y carbamatos (9, 10, 16). Aunque la determinación de ambas enzimas se realiza ampliamente en nuestro medio, pocos estudios se han hecho sobre la estabilidad de la ColP (1, 6) y revisando la literatura no encontramos ningún informe sobre la estabilidad de la AColE. Por tal motivo se consideró de interés determinar la estabilidad de ambas enzimas bajo diferentes condiciones de almacenamiento.
MATERIALES Y MÉTODOS
Muestras
Se emplearon muestras anticoaguladas
con EDTA. Para la detenninación de la estabilidad de la ColP se
usaron mezclas de plasmas, las cuales fueron separadas en volúmenes
de 250 uL y almacenadas a temperatura ambiente, +4 °C y 20 °C por
un periodo máximo de 3 meses. Para determinar la estabilidad de
la AcolE se emplearon tanto eritrocitos lavados con solución salina
isotónica (NaCI, 0,85%), como muestras de sangre total. Ambos tipos
de muestra fueron almacenados en condiciones similares a las mezclas de
plasma.
Métodos para determinar
actividad de ColP y AcolE
Para la determinación
de la actividad de ambas enzimas se emplearon reactivos de Biotec Internacional,
San José, Costa Rica. Los métodos se basan en la reacción
de Ellman (3, 9) usando como sustrato
propioniltiocolina para ColP y acetiltiocolina para AColE en presencia
de un inhibidor para la ColP. Las pruebas se llevaron a cabo a 30 °C
en un espectrofotómetro Shimadzu UV-160 (Shimadzu, Kioto, Japón).
El coeficiente de variación para ColP es de 3,0 % y para AColE de
4,6 % (15). Cada muestra se analizó por cuadriplicado.
Análisis estadístico
Para el análisis
estadístico de los resultados se empleó la prueba de Dunnett
comparando cada grupo de resultados con el valor basal y un nivel de significancia
de 0,05.
RESULTADOS

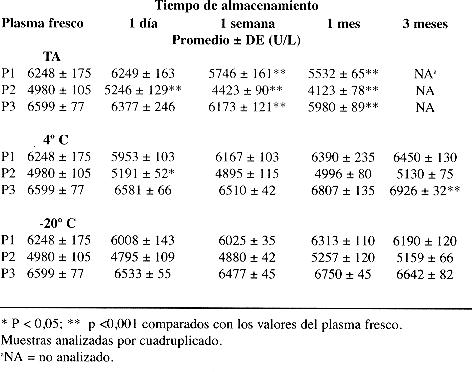
El cuadro 1 muestra los resultados de los análisis realizados para la ColP. Como puede observarse, la enzima muestra una buena estabilidad mantenida en refrigeración (4 °C) y en congelación (a -20 °C). Las diferencias significativas encontradas con las muestras P3 a los tres meses a 4 °C y P2 al mes a -20 °C, están dentro de los límites de la variabilidad analítica propia del método empleado. En todas las muestras conservadas a temperatura ambiente se observa una disminución importante (6 a 11 %) en la actividad de ColP a la semana de almacenamiento. Aunque estos valores estuvieron dentro de lo esperado por variación analítica del método. Sin embargo, al mes de almacenamiento las disminuciones son superiores a lo esperado por variación analítica.
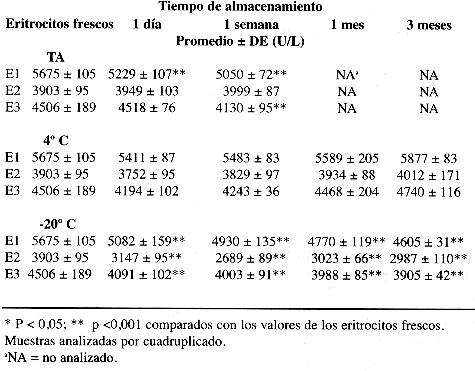
En cuanto a la estabilidad de la AcolE, en el cuadro 2 se presentan los resultados obtenidos al analizar eritrocitos lavados y conservados en solución salina isotónica. En este caso la AcolE se mantuvo estable únicamente en las muestras conservadas en refrigeración. Los resultados a temperatura ambiente no son uniformes. Con un día de almacenamiento bajo estas condiciones, una muestra tuvo pérdida de actividad; pero a la semana otra muestra aún presentaba valores de actividad similares a la inicial. Por otro lado, todas las muestras almacenadas en congelación presentaron disminución significativa en la actividad. Las muestras conservadas por un día a -20 °C, presentaron actividades de AcolE entre 9 y 20 % más bajas que la actividad basal. Los valores de actividad estuvieron fuera de las dos desviaciones estándar esperadas por variación analítica del método.
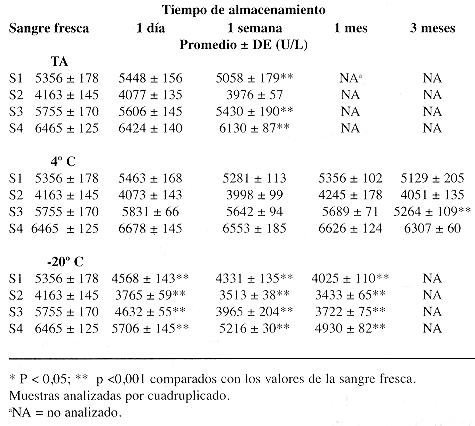
Los resultados obtenidos
al analizar la actividad de la AcolE en sangre total se muestran en el
cuadro 3. A la semana de almacenamiento a temperatura
ambiente, el 50 % de las muestras aún conserva actividades similares
a los valores basases y las disminuciones en el otro 50 % son menores a
las dos desviaciones estándar de variación analítica
esperadas para el método. Por su parte en refrigeración,
la actividad de AColE en sangre total se mantuvo estable en todas las muestras
durante el periodo de evaluación. De nuevo en este caso, todas las
muestras almacenadas en congelación presentaron disminución
significativa en la actividad. La actividad de la enzima en las muestras
conservadas por un día a -20 °C fue entre 10 y 20 % más
baja que la actividad basal. Estas disminuciones fueron superiores a la
variación analítica esperada.
La determinación de las colinesterasas ha adquirido gran importancia clínica debido a la amplia aplicación de plaguicidas organofosforados y carbamatos. Estos compuestos son potentes inhibidores de ambas enzimas, produciendo disminuciones de la actividad de la colinesterasa sérica y eritrocítica debido a inhalación, ingestión a absorción por piel (16). Ambas enzimas son inhibidas, pero la actividad de la enzima sérica disminuye más rápidamente que la eritrocítica, por lo que la determinación de la actividad sérica es un índice muy sensible para prevenir intoxicación. Un inconveniente de la enzima sérica es su poca especificidad, anemia, en infecciones, por drogas (estrógenos) y en casos de variantes genéticas (9, 16). La determinación de la actividad de AColE es de importancia en los sistemas de vigilancia para intoxicaciones crónicas, ya que permance deprimida por más tiempo que la sérica (16). La AColE se considera un mejor índice de la exposición a plaguicidas, debido a que se mide la misma enzima que actúa en el tejido nervioso. Asimismo se considera más específica en este sentido, por ser menos afectada por otras condiciones y a la fecha no se han reportado variantes genéticas que disminuyen su actividad. Sin embargo, actividad disminuida de acetilcolinesterasa se observa en tipos específicos de células en las hemoglobinuria paroxística nocturna (9). En nuestro medio es común el empleo de plaguicidas organofosforado y carbamatos, que inhiben ambas colinesterasas (4). La intoxicación por plaguicidas organofosforados puede causar enfermedad severa incluyendo la muerte y daño cerebral permanente en los sobrevivientes (5). Como una medida preventiva, los trabajadores en contacto con tales compuestos deben ser controlados continuamente, para identificar a las personas sobreexpuestas. Esto se realiza mediante la determinación de la actividad de las colinesterasas, ya que la actividad enzimática disminuye antes de que se presenten manifestaciones clínicas (5, 11). Si el trabajador no muestra síntomas el tratamiento es preventivo, retirándolo de la exposición para darle un seguimiento apropiado y prevenir una sobre-exposición (2, 16). En Costa Rica el sistema de vigilancia relacionado con los plaguicidas inhibidores de las colinesterasas ha adoptado el análisis frecuente de los niveles de estas enzimas como uno de los criterios fundamentales para decidir el diagnóstico. Como en ciertas ocasiones las muestras deben ser transportadas, almacenadas o ambos, consideramos de importancia estudiar la estabilidad de ambas enzimas bajo diferentes condiciones de almacenamiento.
En este estudio se observó que la actividad de la ColP permanece estable por lo menos durante un periodo de tres meses en refrigeración y en congelación. Estos resultados concuerdan con lo informado por otros autores (6, 13). Aunque algunos informan que mantenida a 4 °C la ColP es estable únicamente por una semana, pues sus valores tienden a aumentar (1). Es importante destacar que en nuestros resultados también se observó en las muestras en refrigeración una tendencia hacia el aumento en la actividad, sin embargo los resultados se mantuvieron dentro de los límites esperados por variación analítica. Este fenómeno no se presenta en las muestras conservadas a -20 °C, la cual pareciera ser la mejor temperatura de almacenamiento. Mantenida la temperatura ambiente la enzima no es estable, a la semana de almacenamiento ya se observan disminuciones significativas importantes (6 a 11 %) aunque los valores estuvieron dentro de los esperados por variación analítica del método. Al mes de almacenamiento las disminuciones en la actividad de la enzima son superiores a lo esperado por variación analítica. Estos resultados contrastan en cierta medida con los de algunos autores, los cuales informan que la ColP es estable hasta por 80 días a temperatura ambiente (3), pero concuerdan con lo informado por otros que señalan una estabilidad de pocos días a 20 °C (14). Los resultados nos hacen concluir que la mejor forma para conservar las muestras para análisis de ColP es en congelación. En cuanto a la AcolE, en eritrocitos lavados y conservados en solución salina isotónica se mantuvo estable durante el periodo de evaluación únicamente en las muestras conservadas en refrigeración. A temperatura ambiente no se obtuvieron resultados uniformes. Pero se puede concluir que bajo estas condiciones la enzima no es estable en todos los casos, lo que podría indicar diferencias en cuanto a estabilidad de variantes genéticas. Un hallazgo muy importante, no descrito en la literatura revisada, es que el proceso de congelamiento ocasiona que las muestras pierden gran parte de la actividad de AcolE. Todas las muestras almacenadas en congelación presentaron disminución significativa en la actividad. Las muestras conservadas por un día a -20 °C, presentaron actividades de AcolE entre 9 y 20 % más bajas que la actividad basal, lo cual no se explica por variación analítica.
Conservada en sangre total la AcolE muestra un comportamiento similar a los eritrocitos lavados. A la semana de almacenamiento a temperatura ambiente el 50 % de las muestras aún conserva actividades similares a los valores basales y las disminuciones en el otro 50 % son menores a las dos desviaciones estándar de variación analítica esperadas para el método. Esto indica que en sangre total la enzima es un poco más estable que en eritrocitos lavados. En refrigeración (4 °C) la actividad de AColE en sangre total se mantuvo estable durante el periodo de evaluación. También en el caso de la sangre total se observó que el proceso de congelamiento y descongelamiento provoca disminución importante en la actividad de la AcolE. La actividad de la enzima en las muestras conservadas por un día a -20 °C fue entre 10 y 20 % más baja que la actividad basal. Con base en los resultados de este estudio se recomienda el almacenamiento prolongado de las muestras para el análisis de ColP en congelación. No obstante, la refrigeración es adecuada siempre y cuando el almacenamiento sea por un periodo corto. En muestras mantenidas a temperatura ambiente esta enzima no debe determinarse después de 7 días. En el caso de las muestras para AcolE, la inestabilidad de la enzima requiere mayor atención en el manejo de las muestras que la que se le da comúnmente. Se recomienda mantener las muestras de sangre total en refrigeración. Tales muestras no deben congelarse debido a que pierden mucha de la actividad de AColE en el proceso de congelación-descongelación. Si las muestras se mantienen a temperatura ambiente esta enzima no debe determinarse después de 7 días.
RESUMEN
Se evaluó la estabilidad de la colinesterasa plasmática y la colinesterasa eritrocítica a temperatura ambiente, 4° C y -20 °C, durante un periodo de tres meses. Se determinó que la colinesterasa plasmática es estable en refrigeración y congelación. A temperatura ambiente la actividad de esta enzima disminuye significativamente en una semana. Por su parte la colinesterasa eritrocítica es estable únicamente en refrigeración. El proceso de congelamiento y descongelamiento provoca disminución importante en la actividad de la enzima. En las muestras conservadas por un día a -20 °C, la actividad de la enzima eritrocitaria fue entre 10 y 20 % más baja que la actividad basal. A temperatura ambiente la actividad de esta enzima disminuye en forma importante en una semana.
Palabras claves: colinesterasa
plasmática, colinesterasa eritrocítica, plaguicidas, organofosforados,
carbamatos, toxicología.
BIBLIOGRAFÍA
1- Balland
M, Vincent-Viry M, Henny J. Effect of long-term storage on human plasma
cholinesterase activity. Clin
Chim Acta 1992; 211: 129-13 1.
2- Coye MJ,
Lowe JA, Maddy KT. Biological monitoring of agricultural workers exposed
to pesticidas:
1.Cholinesterase activity determinations. J Occup Med 1986; 28: 619-627.
3- Dietz
A, Rubinstein H, Lubrano T. Colorimetric deterinination of serum cholinesterase
and its genetic variants by
the propionylthiocholine-dithiobis
(nitrobenzoic acid) procedure. In Selected Methods of Clinical Chemistry.
Vol. 8.
Washington
DC: American Association of Clinical Chemistry; 1977. pp. 41-46.
4- García -Gonzalez JE. Causas del mal uso de los plaguicidas. Tecnología en marcha 1996; 12: 25-37.
5- Henao
S, Corey G. Plaguicidas inhibidores de las colinesterasas. Centro Panamericano
de Ecología Humana y
Salud. ECO/OPS/OMS. Metepec, Mexico, 1991.
6- Huizenga
JR, van der Belt K, Gips CH. The effect of storage at different temperatures
on cholinesteras
activity in human serum. J Clin Chem Clin Biochem 1985; 23: 283-285.
7- Kutty DM, Review. Biological functions of cholinesterase. Clin Biochem 1980; 13:239-243.
8- Lepage
L, Schiele F, Gueguen R, Siest G. Total cholinesterase in plasma. Biological
variations and reference
limits. Clin Chem 1985; 31: 546-550.
9- Lotti M. Cholinesterase inhibition. Complexities in interpretation. Clin Chem 1995; 41: 1814-1818.
10- Magnotti
RA, Eberly JP, Quarm DEA, McConnell RS. Measurement of acetylcholinesterase
in erythrocytes in
the field. Clin Chem 1987; 33: 1731-1735.
11- McConnell
R, Cedillo L, Keifer M, Palomo MR. Monitoring organophosphate insecticide-exposed
workers for
cholinesterase depression. J Occup Med 1992; 2: 34 - 37.
12- McQueen
MJ. Clinical and analytical considerations in the utilization of cholinesterase
measurements. Clin
Chim Acta 1995; 237: 91-105.
13- Panteghini
M, Bonora R, Pagani F. Evaluation of a new method for cholinesterase determination.
Clin
Biochem 1986; 19:161-165.
14- Schmidt
E. Deutsche Gesellschaft für Klinische Chemie. Working Group of enzymes:
Proposal of standard
methods for the determination of enzyme catalytic concentrations in serum
and plasma at 37 °C. 11.
Cholinesterase. Eur J Clin Chem Clin Biochem 1992; 30: 163-170.
15- Schosinsky
K, Jiménez M. Valores de referencia de colinesterasa plasmática
y eritrocítica en población
costarricense. Comparación del desempeño clínico.
Pan Am J Public Health. En prensa.
16- Trundle
D, Macial G. Detection of cholinesterase inhibition. The significance of
cholinesterase
measurements. Ann Clin Lab Sci 1988; 18:345-352.