ARTÍCULO ORIGINAL
Anatomía Microquirúrgica
de la bifurcación carotídea en aneurismas gigantes
Microsurgical Anatomy of the carotid
bifurcation in giant aneurysms
Manuel S. Gadea Nieto*
Artículo recibido:31-07-2001
- Aprobado 31-07-2002
Abstract
Giant aneurysms
of the carotid bifurcation (CB) are no frequent, even in reference and
concentration hospitals. Its incidence varies from 1.5 to 8% of all intracranial
aneurysms. These lessions comprises 40% of the total cases during the second
decade of life seen in a neurovascular surgical department.
Since the introduction of
microsurgical techniques, the morbidity and mortality improves thanks to
the better understanding of the microsurgical anatomy involved in these lesions, however
there are reports with mortalities as high as 40%. With skull base surgical
approaches, depurating microsurgical techniques, and a detailed knowledge
of the microsurgical anatomy, mortality will be in between 2 and 4%.
Key words: carotid
bifurcation, microsurgical anatomy, microsurgery.
Resumen
Aún
en hospitales de referencia y concentración, los aneurismas gigantes
de la bifurcación carotidea (BC) son poco frecuentes; su incidencia
oscila entre 1.5 y 8% de los aneurismas intracraneal os. Durante la segunda
década de la vida, estas lesiones comprenden hasta el 40% de la totalidad
de casos vistos en un servicio de cirugía neurovascular.
A partir
de la introducción de las técnicas microquirúrgicas,
la morbilidad y mortalidad mejoraron sustancialmente y esto se debió
al mejor conocimiento de la anatomía microquirúrgica envuelta
en este tipo de lesiones, sin embargo, hay reportes de mortalidades tan
altas como del 40%. Con la utilización de abordajes de cirugía
de base de cráneo, técnicas microquirúgicas depuradas
y sobre todo, con el dominio detallado de la anatomía microquirúrgica,
la mortalidad hoy en día oscila entre 2 y 4%.
Palabras clave: Bifurcación
carotídea, anatomía microquirúrgica, microcirugía.
Introducción
Los aneurismas
gigantes de la bifurcación carotídea (BC) tienen una incidencia
que oscila entre 1.5 y 8% de los casos; en nuestra serie, la incidencia
es del 4.4%; comprendiendo más del 40% de los casos en pacientes
de la segunda década de la vida (1,2,3,4,5)
. Por razones hemodinámicas, estas
lesiones son una continuación
directa del tronco de la arteria carótida interna (ACI), proyectándose
hacia arriba o hacia arriba y hacia atrás(6).
De hecho, algunos aneurismas gigantes de esta localización al proyectarse
hacia arriba, pueden producir obstrucción del agujero de Monro, ocasionando
hidrocefalia obstructiva (7,8);
en los casos en los que no ha habido ruptura de la lesión, la hidrocefalia
se puede manifestar por un cuadro demencial, de presentación insidiosa,
asociándose a ataxia de Brums y apraxia, así como incontinencia
urinaria. Rara vez, los aneurismas de esta localización se proyectarán
en sentido anterior o posterior.
En nuestra
experiencia, estos aneurismas se presentan con cuadros de hemorragia subaracnoidea
hasta en un 75% de los casos (figura 1A), aunque las manifestaciones de
efecto de masa no son infrecuentas (figura 1A y D)
(9, 10, 11,
12). La compresión de estructuras neurales
y sobre todo de la vía óptica, integrada en el síndrome
optoquiasmático, es bien conocida (13, 14, 15).
Algunos
autores han encontrado altas incidencias de hematomas parenquimatosos en
el cuadro de presentación de este tipo de lesiones (11); en series extensas se reportan localizadas al
1óbulo temporal hasta en un 50% de los casos y en un 27% situadas
en el lóbulo frontal; la incidencia de hematomas subdurales asociados,
oscilan desde 4% hasta 35% (10, 13),
en nuestra serie no hubo ningún caso con hematoma subdural asociado.
Los aneurismas gigantes de
la BC están localizados en un Area microanatómica compleja,
requiriéndose para su manejo, un amplio conocimiento de la anatomía
microquirúrgica, con el desarrollo de técnicas micro quirúrgicas
y de cirugía de base de cráneo sólidas.
En el presente, tratamos,
basándonos en la experiencia de los casos y los años, dar un
panorama de las estructuras involucradas en este tipo de casos
(figura 1A, B, C y D.)
Anatomía y Variantes Pertinentes
Para manejar
aneurismas gigantes de la BC es indispensable el conocimiento y entendimiento
de la anatomía micro quirúrgica alrededor de la bifurcación, especialmente
de la de las arterias perforantes, las que difícilmente se logran
apreciar en el estudio angiográfico (figura 1B
y C). De las estructuras vasculares que se manejan durante ese tipo de casos,
las más relevantes son: arteria comunicante posterior (AcoP), arteria
coroidea anterior (AchoA), perforantes de Al, arteria recurrente de Hübner y las
perforantes proximales del tronco principal de la arteria cerebral media
(MI).
Arteria comunicante posterior (AcoP).
Usualmente se origina de la superficie posterior de la ACI, pasando posterior
y medialmente por arriba de la silla turca y el nervio motor ocular común
(III); se une a la arteria cerebral posterior (ACP), completando el aspecto
posterior del polígono de Willis; embriológicamente, tanto
la AcoP, como la ACP se originan del sistema carotídeo, sin embargo,
durante el desarrollo, la AcoP deja de crecer y la ACP se anexa al sistema
vértebro-basilar; en un 22% de los casos la AcoP persiste siendo "fetal",
dando el mayor aporte sanguíneo a la ACP (16);
en este tipo de casos la AcoP cursa póstero-lateralmente, ya sea
sobre o lateral al III.
Un hallazgo relativamente
frecuente en los estudios angiográficos es la dilatación
infundibutiforrne, la que está presente hasta en un 6.5% de estudios
arteriográficos normales, lo que continua generando discrepancias
en cuanto a si esta dilatación es o no una lesión pre-aneurismática
(17).De la AcoP se originan un número variable de perforantes
(en promedio: 7-8), a las que colectivamente se les denomina tálamo-
perforantes anteriores, teniendo éstas un curso en dirección
superior hacia la porción pre-mamilar del piso del tercer ventrículo,
la sustancia perforada posterior y la fosa interpeduncular; estas perforantes irrigan
el tálamo, el hipotálamo, el subtálamo y la cápsula
interna y algunas cuantas contribuyen en la irrigación del quiasma
óptico, el tracto óptico y el tallo pituitario (18, 19). Comúnmente estas
perforantes se originan del tercio medio de la arteria.
Arteria coroidea
anterior (AchoA). Al igual que la AcoP, se origina de la superficie posterior
de la ACI, inmediatamente lateral a la comunicante y su porción inicial
o cisernal cursa en dirección posterior, inferior al tracto óptico
y lateral a la CoP, hasta alcanzar el borde lateral del pedúnculo
cerebral(18, 20, 21). Las ramas del segmento cisernal irrigan el tracto
óptico, el pedúnculo cerebral, el cuerpo geniculado lateral
y el lóbulo temporal; en el borde anterior del cuerpo geniculado lateral,
la AchoA cruza el tracto óptico de medial a lateral para situarse
cerca del uncus. El segmento del plexo se inicia al momento que el vaso penetra
la hendidura coroidea para irrigar el plexo coroideo en el cuerno temporal
y ventrículo lateral; este segmento también irriga partes de
la cápsula interna, tálamo, cuerpo geniculado lateral, pedúnculo
cerebral y tracto óptico. Las ramas perforantes se originan en forma
frecuente del segmento coroideo de la ACI, distales al origen de la AchoA
e irrigan la sustancia perforada anterior, el quiasma óptico y el
uncus.
A pesar de que
la AchoA es más delgada que la AcoP, irriga áreas más
extensas(18). Esta arteria, contrariamente
a la creencia antigua, nunca deberá de ser sacrificada durante el
acto quirúrgico; la sintomatología que se deriva de su oclusión,
es lo que se conoce como síndrome de Abbie. Durante la intervención
quirúrgica, a pesar de haberse identificado la AchoA, se debe de
tener presente la posibilidad de una segunda arteria existente como variante
anatómica; algunas veces la arteria se duplica u origina pequeñas
ramas y en otras, el segundo tronco se esconde detrás de la ACII(22).
A1, sus perforantes,
arteria recurrente de Hübner y las perforantes de Ml: la ACA es la
más pequeña de las dos ramas terminales de la ACI, originándose
en la bifurcación, por debajo de la sustancia perforada anterior;
el segmento inicial de la ACA, Al, corre desde la bifurcación hasta
el origen de la AcoA, cursa medial y anterior, sobre el nervio óptico
y el quiasma, situándose inmediatamente por delante de la lámina
terminalis. De Al toman origen numerosas ramas perforantes, las que penetran
la sustancia perforada anterior por su porción antero-medial, para
irrigar la región septal y el hipotálamo (23).
La mayoría de las
perforantes de Al se originan de las paredes superior o posterior, en su
segmento proximal, cerca de la BCI(24, 25). El área de distribución vascular
de estas perforantes se traslapa durante parte de su recorrido con ramas
perforantes proximales de M1; cuando las perforantes de M1 no alcanzan su
desarrollo normal, las de A1 alcanzan diámetros superiores.
La arteria recurrente de
Hübner toma su origen en posición superior o posterior en relación
con A1, haciendo un bucle sobre la BC, penetrando la sustancia perforada
anterior(24, 26). La porción
proximal de esta arteria se
encuentra generalmente en el espacio entre el lóbulo frontal y A1
distal, en el nervio óptico. En algunas ocasiones pasa por detrás
de la ACI, por debajo de la BC. Según hemos podido observar durante
las intervenciones quirúrgicas, aproximadamente en el 60% de las veces,
la arteria recurrente de Hübner pasa por encima de la pared superior
de A1, pasando por debajo de la BC, denominándose a esta posición,
tipo superior(25); en algunos casos, la arteria
se esconde detrás del aneurisma y tiene un recorrido por arriba del
nivel de la bifurcación.
Las perforantes que tienen
origen en la porción proximal de M1, son escasas en cantidad y como
se mencionó anteriormente, se traslapan en su recorrido proximal con las perforantes de A1. Estas
arterias perforantes se denominan en conjunto arterias lentículo-estriadas,
penetran la sustancia perforada anterior para irrigar la cápsula
interna, la cabeza y el cuerpo del caudado y la parte lateral del globo pálido;
además, en este segmento proximal de M1I se originan ramas corticales
tempranas destinadas a los lóbulos frontal y temporal(26).
Habiendo repasado las estructuras
vasculares involucradas en la región de la BC nos percatamos de
las relaciones con estructuras nerviosas importantes, así como
el sinnúmero de elementos vasculares que se deberán de identificar
durante el manejo de aneurismas gigantes de esta localización, de
ahí la importancia de tener un conocimiento
detallado de la anatomía micro quirúrgica y microvascular
al momento de escoger la estrategia quirúrgica a desarrollar (Figuras
2, 3, 4).
Conclusiones
El dominio
de la anatomía micro quirúrgica y microvascular, así
como el conocimiento de las variantes anatómicas y las ocasionadas
por el aneurisma en si son de capital importancia para el adecuado manejo
de las lesiones consideradas como gigantes. Generalmente el saco del aneurisma
se encuentra adherido a la superficie inferior del 1óbulo frontal,
desprendiéndose de esto que estas lesiones no deberán de abordarse
por vía subfrontal, ya que las posibilidades de traccionar inadecuadamente
la lesión y ocasionar una catástrofe es muy alta.
En nuestra
estrategia quirúrgica tenemos algunos dogmas para el manejo de este
tipo de lesiones y las cuales son: crear el suficiente campo de trabajo,
teniendo cuidado en proteger
el tejido cerebral; establecer claramente las relaciones anatómicas,
las que pudieran ser diferentes a aquellas obtenidas del estudio angiográfico
preoperatorio; tener en mente las opciones en caso de ruptura prematura
del aneurisma; inspección minuciosa de la colocación del clip,
descartándose el involucramiento de estructuras importantes en sus
hojas y finalmente, nunca escatimar tiempo para recolocar un clip con el
cual no estemos plenamente satisfechos de su situación espacial (figura
4).
Las ramas
perforantes presentes en el área de trabajo (figura 2, 3, 4)
de aneurismas gigantes de la BC son de capital importancia, tienen topografía
muy variable; existen algunos casos en los que las perforantes que normalmente
se originan de la AchoA, se originan de la misma ACI, debiéndose identificar
plenamente y bajo ninguna circunstancia, sacrificarse.
Es importante recordar que
los aneurismas gigantes en general son un reto para el neurocirujano, presentando
un problema terapéutico en la toma de decisiones, cada paciente es único
y por ende, deberán de ser individualizados y las modalidades de
tratamiento, críticamente analizadas.
Los aneurismas
de flujo y presión altos, así como aquellos con cuellos grandes,
deberán de manejarse con "atrapamiento" temporal siempre (figura
3), debiéndose de descomprimir el saco (figura
3) para eliminar la compresión sobre las
estructuras nerviosas circundantes. Cuando tengamos necesidad de reconstruir
microvascularmente la lesión y esto implique sacrificar A1, debemos
de tener en cuenta la competencia de las estructuras de la parte anterior
del polígono de Willis obtenida del estudio arteriográfico
preoperatorio.
Referencias
- Laranjeira
M, Sadasivan B, Asuman JI: Direct surgery for carotid bifurcation artery
aneurysms. Surg. Neurol. 1990; 34: 250.
- Locksley
HB: Report on cooperative study of intracranial aneurysms and subarachnoid
hemorrhage, section V I: natural history of subarachnoid hemorrhage, intracranial
aneurysms and arteriovenous malformation. J Neurosurg. 1966; 25: 219.
- Sengupta
RP, Lassman LP, De Moraes AA, et al: Treatment of internal carotid bifurcation
aneurysms by direct surgery. J Neurosurg. 1975; 43: 343.
- Sahs
AL, Perret GE, Locksley HB, et al (eds): Intracranial aneurysms and subarachnoid
hemorrhage. A cooperative study. Philadelphia, Lippincout, 1969.
- Heiskanen
0: Ruptured intracranial arterial aneurysms of children and adolescents.
Surgical and total management results. Childs Nerv. Syst 1989; 5; 66.
- Da
Pian R, Pasqualin A, Scienza R: Direct microsurgical approach to aneurysms
of the internal carotid bifurcation. Surg. Neurol. 1980; 13: 27.
- Bull
J: Massive aneurysms at the base of the brain. Brain 1969; 92: 535.
- Morota
N, Ohtsuka A, Kameyana S, et al: Obstructive hydrocephalus due to a giant
aneurysms of the internal carotid artery bifurcation. Surg. Neurol. 1988;
29: 22 7.
- Viñuela
F. Fox A, Chang JK, et al: Clinico-radiological spectrum of giant supraclinoid
internal carotid artery aneurysms. Neuroradiology. 1984; 26: 93.
- Inagmpa
t, Hirano A: Ruptured intracranial aneurysms: an autopsy study of 133 patients.
Surg. Neurol. 1990; 33: 117.
- Pasqualin
A, Bazzan A, Cavazzani P et al: Intracranial hematomas following aneurismal
rupture: experience with 309 cases. Surg. Neurol. 1986; 25: 6.
- Morley
TP Barr HWK: Giant intracranial aneurysms: diagnosis, course, and management.
Clin. Neurosurg. 1969; 16: 73.
- Barnett
HJM: Some clincial features of intracranial aneurysms. Clin. Neurosurg.
1968; 16: 43.
- Fisher
CM: Clinical syndromes in cerebral thrombosis, hypertensive hemorrhage
and ruptured saccular aneurysms. Clinical Neurosurg. 1975; 22: 117.
- Jefferson
G: Compression of chiasma, optic nerves and optic tracts by intracranial
aneurysms. Brain. 1937; 60: 444.
- Saeki
N, Rhoton AL, Jr: Microsurgical anatomy of the upper basitar artery and
the posterior circle of Willis. J. Neurosurg. 1977; 46: 563.
- Hassler
0, Salzman GF: Angiographic and histologic changes in infundibular widening
of the posterior communicating artery. Acta Radiol. 1963; 1: 321.
- Gibo
H, Lenkey C, Rhoton AL, Jr: Microsurgical anatomy of the supraclinoid portion
of the internal carotid artery. J. Neurosurg. 1981; 55: 560.
- Pedroza
A, Dujovny M, Cabezudo-Artero J, Umansky F Berman SK, Diaz FG, Ausman JI,
Mirchandani G: Microanatomy of the premamillary artery. Acta Neurochir. (Wien)
1987; 86: 50.
- Rholon
AL, A Fuji K, Fradd B: Microsurgical anatomy of the anterior choroidal
artery. Surg. NeuroL 1979; 12: 171.
- Fuji
K, Lenkey C, Rhoton AL, Jr: Microsurgical anatomy of the choroidal arteries:
lateral and third ventricles. J. Neurosurg. 1980; 52: 165.
- Yasargil
MG, Yonas H, Gasser JC: Anterior choroidal artery aneurysms: their anatomy
and surgical significance. Surg. Neurol. 1978; 9: 129.
- Rosner
SSS, Rholon AL, Jr, Ono M, et al.: Microsurgical anatomy of the anterior
perforating arteries. J. Neurosurg. 1984; 61: 463.
- Marinkovic
S, Milisavjevic M, Kovacevic M: Anatomical bases for surgical approach to
the initial segment of the anterior cerebral artery, microanatomy of Hübner´s
artery and perforating branches of the anterior cerebral artery. Surgical
radiologic anatomy. 1986; 8: 7.
- Gomes
FB, Dujovny M, Umansky F et al.: Microanatomy of the anterior cerebral artery.
Surg. Neurol. 1986; 26: 129.
- Kribs
M, Kleihues P: The recurrent artery of Hübner In Zülch AJ ed.:
Cerebral circulation and stroke. New York, Srpinger-Veriag, 1971; 40.
- Gibo
H, Carver C, Rhoton AL, Jr et al.: Microsurgical anatomy of the middle
cerebral artery J Neurosurg. 1981; 54: 151.
Reconocimiento
Deseo expresar mi agradecimiento
a la Licda. Alejandra Duque Estrada Ortiz por su excelente trabajo artístico
y a los Residentes, quienes alguna vez fueron mis alumnos y me motivaron
en la creación del Laboratorio de Microcirugía- de nuestro
Hospital.
 Figura 1. (A, B, C):
imágenes tomográficas y angiografía preoperatoria del
aneurismo paraclinoidea
gigante del caso ilustrativo parcialmente trombosado.
Figura 1. (A, B, C):
imágenes tomográficas y angiografía preoperatoria del
aneurismo paraclinoidea
gigante del caso ilustrativo parcialmente trombosado.
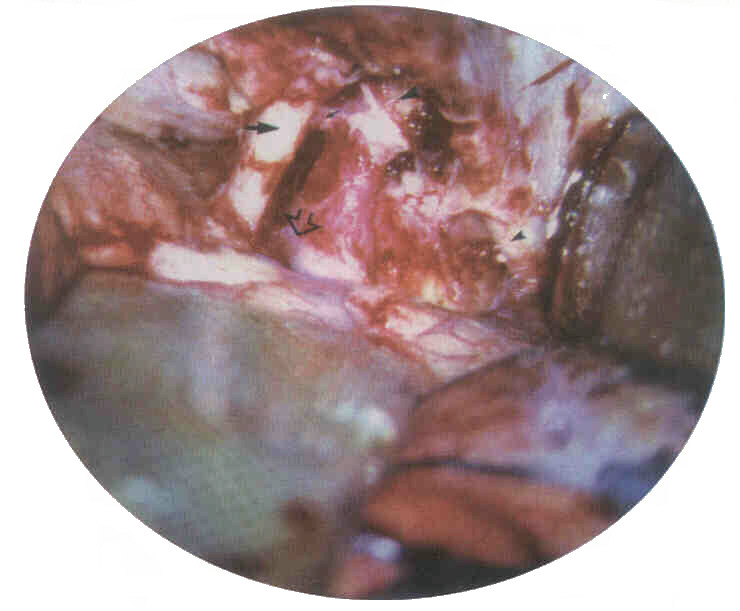 Figura 2. Microfotografía
del campo operatorio posterior de la clinoide anterior
y el soporte óptico
observándose el nervio óptico, la arteria oftálmica,
el III par,
la porción distal
del sifón carotídeo y el aneurisma.
Figura 2. Microfotografía
del campo operatorio posterior de la clinoide anterior
y el soporte óptico
observándose el nervio óptico, la arteria oftálmica,
el III par,
la porción distal
del sifón carotídeo y el aneurisma.
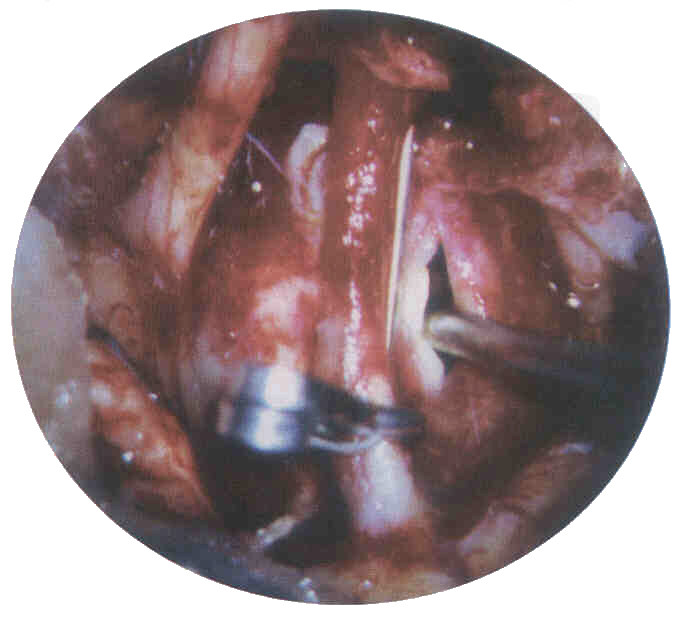 Figura 3. Colocación
de un clip fenestrado recto y aspecto operatorio de la maniobra de Dallas.
Figura 3. Colocación
de un clip fenestrado recto y aspecto operatorio de la maniobra de Dallas.
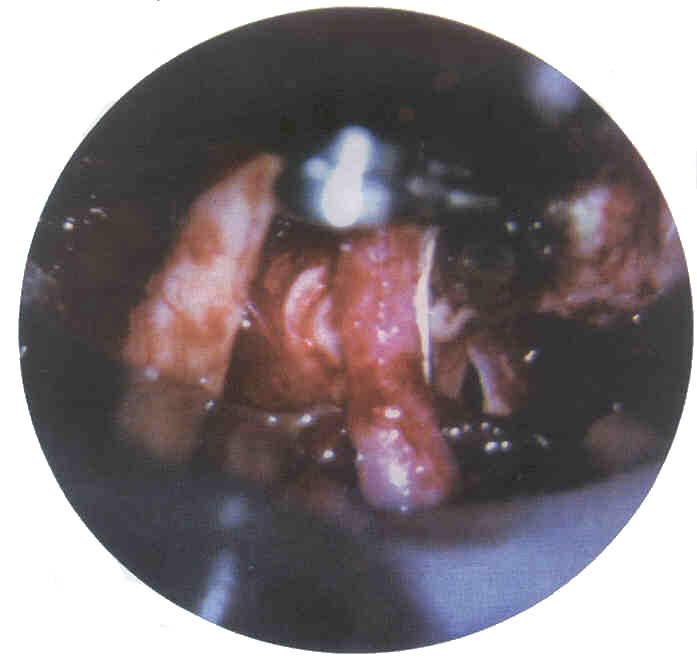 Figura 4. Aspecto del
campo operatorio posterior a la reubicación del clip.
Figura 4. Aspecto del
campo operatorio posterior a la reubicación del clip.
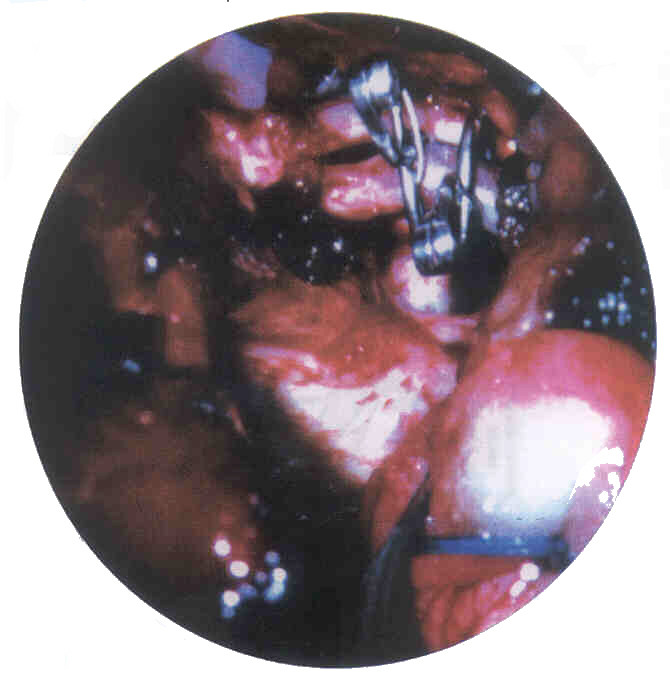 Figura 5. Aspecto transquirúrgico
del clips fenestrados colocados para la
reconstrucción
microvascular de la pared posterior del vaso, tiempo intracavernoso.
Figura 5. Aspecto transquirúrgico
del clips fenestrados colocados para la
reconstrucción
microvascular de la pared posterior del vaso, tiempo intracavernoso.
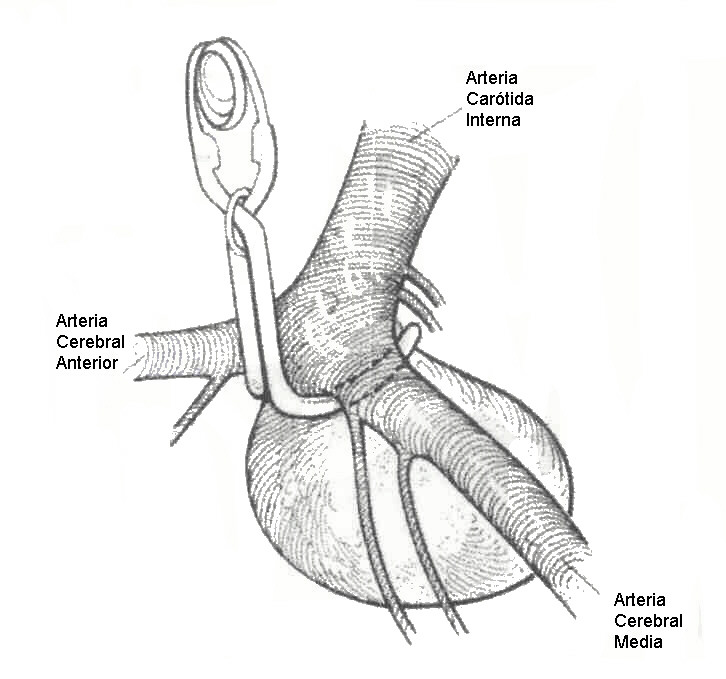 Figura 6. Esquema de
un aneurismo gigante de la BC dirigido en sentido
inferior (raros) y que
presenta ramas perforantes adosadas a su saco, del tronco
carotídeo se
logra visualizar el origen de las arterias CoP y Choa,
en este esquema ejemplificamos
el tipo de clip (curvo de Sugita),
el que consideramos
el idóneo para este tipo de lesiones.
Figura 6. Esquema de
un aneurismo gigante de la BC dirigido en sentido
inferior (raros) y que
presenta ramas perforantes adosadas a su saco, del tronco
carotídeo se
logra visualizar el origen de las arterias CoP y Choa,
en este esquema ejemplificamos
el tipo de clip (curvo de Sugita),
el que consideramos
el idóneo para este tipo de lesiones.
*Miembro activo, Sección Conjunta de Cirugía Cerebro
vascular, Asociación Americana de Cirugía Neurológica,
Consejo Americano de Cirugía Neurológica, Ex-Jefe, Sección de Cirugía
Neurovascular, Hospital General Regional-León, Guanajuato, México
Ex profesor Asociado de Cirugía Neurológica y Neurovascular
H. G. k -León, Gto. Fundador y Ex-Director, Laboratorio de Microcirugía,
H. G. P, -León Gto. México.
CORRESPONDENCIA: Dr. Manuel S. Gadea Nieto, Apartado Postal 818-1100
Tibás, San José, Costa Rica C. A., Correo electrónico:
gadeanms@hotmail.com






