Abstract
With the introduction of minimally invasive surgery techniques, there has been a favorable outcome on neurosurgical procedures, especially those involving surgery of the ventricular cavities and the cranial base. In this paper we report our early experience of the transsphenoidal endoscopic management of two consecutive patients harboring pituitary apoplexy. We review in detail the worldwide experience on this clinical problem and the indications and results of the endoscope assisted procedure.
Keywords:
Pituitary apoplexy, pituitary adenomas, minimally invasive surgery.
Resumen
Con la introducción de las técnicas de abordaje de mínima invasión, se ha logrado una mejoría en el resultado de los procedimientos neuroquirúrgicos, especialmente aquellos que implican cirugía de las cavidades ventriculares y de la base craneal. En el presente artículo se describen dos casos consecutivos de apoplejía hipofisiaria tratados por abordaje transesfenoidal endoscópico. Se describe su presentación clínica, manejo, así como resultados quirúrgicos tempranos.
Palabras clave:
Apoplejía Hipofisiaria, Adenomas hipofisiarios, cirugía de
mínima invasión.
Historia
El primer
reporte documentado de un caso de apoplejía hipofisiaria se atribuye
a Bailey1 en 1898 y posteriormente se describe
otro caso por Bleibtreu2 en 1905, sin embargo
la correlación de los hallazgos clínicos asociados a los cambios
anatomopatológicos fue hecha en 1950 por Brougham3 quien utiliza el término apoplejía hipofisiaria
derivado de los prefijos latinos apo, que significa derivado de y plessein
que significa golpear, es decir deshabilitar de golpe. Sheehan y Murdoch4 en 1938 se refieren a esta entidad como resultado de
la trombosis del sistema portahipofisiario en casos de hipotensión
severa secundaria a hemorragia postparto, sin embargo en 1961 el mismo Sheehan
y Stansfield5 replantean la fisiopatología
del infarto atribuyéndolo a las características particulares
de la vasculatura arterial de la hipófisis.
Epidemiología
El término de apoplejía hipofisiaria se ha empleado comúnmente dentro de la literatura para describir cambios agudos dentro de la glándula hipofisiaria secundarios a infarto o hemorragia dentro de un tumor previamente existente 1,2,10,11,12,13,15,28,38,39, sin embargo también ha sido empleado para describir cambios hemorrágicos dentro de glándulas sin evidencia de tumores6,7.
La incidencia de los tumores hipofisiarios en los Estados Unidos se ha calculado de 0.2 a 0.8 por 100,000 habitantes8. Estos constituyen del 10 al 15% de todos los tumores intracraneanos. La incidencia de microadenomas en series de autopsia se ha calculado en un rango del 10% al 20%9. Estas lesiones rara vez son sintomáticas durante la vida, en oposición a los macroadenomas. Del total de lesiones corroboradas patológicamente, se ha calculado una incidencia de hallazgos hemorrágicos que va de un 6% según López10 hasta un 16% descrita por Wakai11. En esta última serie se documentó evidencia clínica de un episodio mayor en 6.8% de todos los adenomas, un episodio menor en 2.3% y 7.5% de lesiones asintomáticas.
Muller-Jensen y Ludecke12 han encontrado que la incidencia de apoplejía hipofisiaria es mayor en adenomas no secretores, seguida de prolactinomas, sin embargo probablemente esto es solo un reflejo de la incidencia general de subtipos de adenomas hipofisiarios.
En una revisión hecha por Mohr y Hardy13 solamente un 0.6% de 664 pacientes tuvieron manifestaciones clínicas de AH y se pudo demostrar cambios hemorrágicos en un 9.5% de todos los casos.
Con base a los hallazgos de Resonancia Magnética se ha determinado un 26% de cambios hemorrágicos sin tomar en cuenta los hallazgos clínicos.14
El rango de edad descrito oscila entre los 6 y 88 años con un promedio de 46.7 años15.
La relación hombre
/ mujer es de 1.3:115.
Factores predisponentes
En la gran mayoría de los casos, no puede demostrarse una causa directa del incidente de apoplejía. En un porcentaje considerable de los casos esta puede ser la presentación inicial de trastornos hipofisiarios o de endocrinopatía11,15,42.
Los siguientes factores se
han asociado a AH:
Mecanismos fisiopatológicos propuestos
Se ha descrito un riesgo incrementado de hemorragia directamente proporcional al tamaño tumoral, sin embargo hay casos de AH tanto en macroadenomas como en microadenomas8,9, Wakai11 determinó que con respecto al resto de los tumores del SNC, los adenomas de hipófisis sangraban 5.4 veces mas frecuentemente. Aun no se ha definido una explicación satisfactoria para este fenómeno. Durante mucho tiempo se ha planteado que el crecimiento tumoral excede la neovascularización, sin embargo se ha demostrado que en su mayoría, los adenomas hipofisiarios son de crecimiento lento. Otra teoría establece que el crecimiento tumoral dentro de un espacio anatómico confinado y poco distorsionable como es la cavidad selar produce un incremento de la presión compartimentar, con un compromiso de la vascularización al comprimir el infundíbulo hipofisiario con los delicados vasos del sistema porta-hipofisiario. Al ocurrir este fenómeno se origina infarto isquémico de la adenohipófisis15.
En casos donde se ha ocluido deliberadamente el sistema porta-hipofisiario, sin embargo, no hay hemorragia, por lo cual queda pendiente determinar si existen otros factores que expliquen las hemorragias intratumorales como puede ser la predisposición a una vasculopatía local. Adicionalmente, en estudios experimentales se ha demostrado que habitualmente el tronco meningohipofisiario no sufre compresión al ocluir el diafragma selar27.
Independientemente
del factor que origine el evento apopléjico, las manifestaciones
clínicas son el producto del edema tumoral resultante con compresión
de las estructuras de los compartimentos selares laterales (antes conocidos
como senos cavernosos), y de las estructuras del aparato visual, especialmente
en los casos donde existe quiasma prefijados28.
Cuando el contenido de la cavidad selar logra tener acceso a la cisterna
quiasmática, aparecen signos de irritación meníngea
los cuales pueden asociarse a vasculopatía local por vasoespamo, lo
cual origina trastornos de la función hipotálamica y del sensorio.
Manifestaciones clínicas
|
|
|
|
| McFadzean et al28/1991 |
|
|
| Ebersold et al 44/983 |
|
|
| Fraioli et al 25/1990 |
|
|
| Muller-Jensen y Ludecke 12/1981 |
|
|
| Onesti et al29/1990 |
|
|
| Laws y Ebersol 30/1982 |
|
|
| Hickstein et al 31/986 |
|
|
| Tsitsopoulos et al 32/1986 |
|
|
| Rachiin et al 33/1989 |
|
|
| Wakai et al 11/1981 |
|
|
| David et al 34/1975 |
|
|
| Berti et al 47/1974 |
|
|
| Bills et al 43/1992 |
|
|
| TOTAL |
|
|
Vómitos
|
|
|
| Leve |
|
| Moderado |
|
| Severo |
|
| Muy Severo |
|
2. Déficits de los
campos visuales:
|
|
|
| Escotoma central |
|
| Bitemporal clásico |
|
| Defectos nasales |
|
| Constricción generalizada |
|
3. Oftalmoparesia:
El nervio más frecuentemente afectado es el oculomotor con la presencia de ptosis, midriasis y desviación inferior y lateral del globo ocular. En orden de frecuencia, el troclear es el nervio craneal que le sigue en frecuencia con manifestaciones de diplopia vertical que se empeora al mirar en sentido contrario o al virar la cabeza en tomo al ojo afectado (hipertrópico).
|
|
|
| III |
|
| IV |
|
| VI |
|
4. Síndrome de Horner.
5. Manifestaciones
de hipertensión de los compartimentos selares laterales.
En adición a los
cambios arriba mencionados, la obstrucción al retomo venoso de la
órbita conlleva a la proptosis y quemosis.
Trastornos
de la conciencia
Puede presentarse desde
letargia hasta el coma30,38,42. La incidencia varía desde un 6.9 a u 64%35 de los pacientes. Son el resultado de la extravasación
de sangre y productos de degradación del tejido hipofisiario necrótico
a espacio subaracnoideo a través de la cisterna optoqiasmática,
con el consecuente fenómeno de vasoespasmo. Otras causas atribuidas
son la hipertensión endocraneana por obstrucción de la circulación
del LCR en las cisternas basales, la herniación del uncus, el desbalance
electrolítico el panhipopituitarismo48.
También puede darse la trombosis del sifón carotídeo al ser comprimido contra la clinoides anterior, con las consecuentes alteraciones de la función hemisférica.
Trastornos
de la función hipotalámica e hipofisiaria
En la tabla
6 se enlista el porcentaje de síntomas encontrados al hacer
un interrogatorio retrospectivo en pacientes con apoplejía hipofisiaria30.
Se debe tener en consideración la existencia de anomalías de las funciones endocrinas hipofisiaria instaladas previas al evento apopléjico y que se agravarán al destruirse los remanentes de tejido hipofisiario sano junto con la necrosis tumoral.
La presencia de fatiga, cefalea, hipotensión postural, nausea, vómitos dolor abdominal trastornos del sensorio debe despertar la sospecha de insuficiencia suprarrenal secundaria, condición que puede ser mortal de no ser corregida en forma temprana36.
Cuando se presenta disfunción hipotalámica se ha descrito hipotensión, fiebre, hipotermia arritmias cardiacas y trastornos ventilatorios.
|
|
|
| Disminución de la líbido/impotencia |
50
|
| Letargo crónico |
50
|
| Intolerancia al frío |
40
|
| Disminución en el crecimiento del pelo |
32
|
| Galactorrea |
8
|
| Trastornos del ciclo menstrual |
16
|
Otras variedades de presentación
Se han descrito
como manifestaciones infrecuentes las crisis convulsivas, afasias, la ataxia37, nistagmus retractorius38,
vértigo11, tetraparesia 39, monoparesia40, anosmia41, epistaxis y licuorrea nasal42.
Hallazgos de laboratorio
El LCR puede ser claro si la hemorragia está confinada al compartimiento selar y tornarse francamente hemorrágico, xantocrómico y turbio al comunicarse con las cisternas basases. La pleocitosis es un hallazgo frecuente aunado a la hiperproteinorraquia43.
|
|
|
| Hiperproteinorraquia (>45 mg/dl) |
90
|
| Xantocromía |
40
|
| Eritrocitos > 100 cel/_ |
41
|
Estudios radiológicos
El estudio de elección por su definición multiplanar y precisión en la presentación de imágenes del contenido selar es la resonancia magnética con medio de contraste.
1. Radiología
convencional
Las radiografías
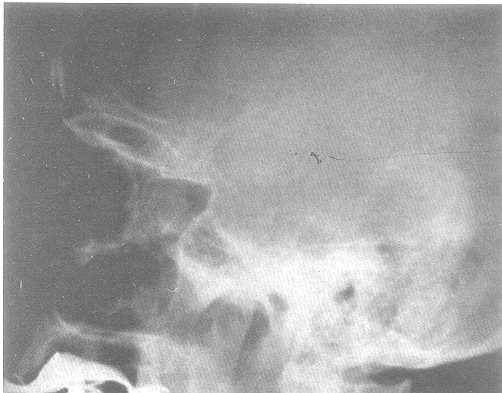
simples pueden ser de gran utilidad al realizar tamizaje de cefaleas (Fig. l). Algunos de los criterios contemplados
son: abalonamiento de la silla, doble contorno selar, erosión y
desmineralización del dorsum sellae, presencia de tejidos blandos
dentro del seno esfenoidal y calcificaciones anormales15.

En la serie de Ebersold todos los pacientes tenían cambios del contorno selar sugestivos de lesión expansivo44.
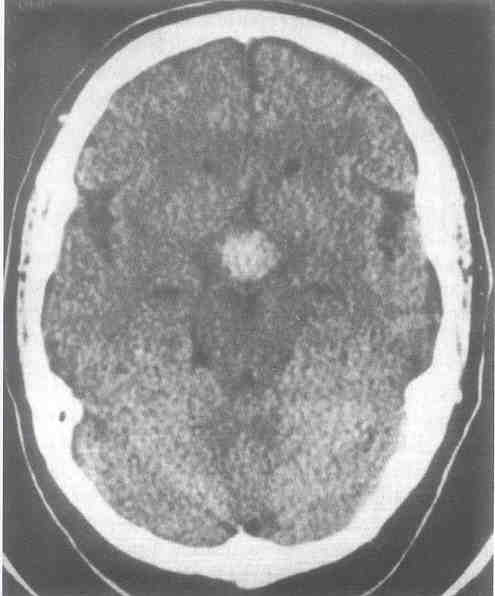
2. Tomografía
axial
Se deberá realizar
un estudio utilizando medio de contraste con cortes axiales de la región
selar. A continuación se administra medio de contraste y se
realizan cortes de 1.0 a 1.5 mm en el plano coronal45.
Si el estudio se realiza dentro del periodo agudo (primeros tres días), se podrá documentar señales hiperdensas dentro de la silla turca con densidades Hounsfield de 75 a 80.
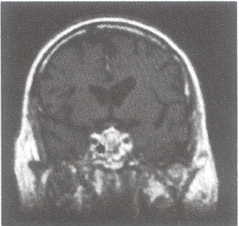
3. Resonancia Magnética

Histopatología
La apoplejía hipofisiaria se asocia casi invariablemente a la presencia de macroadenomas dentro de la silla turca11.
La distribución de dichos macroadenomas puede ser supraselar, lateral, infraselar o mixta35.
Inicialmente se planteo que el tipo histológico predominante de los macroadenomas con hemorragia intratumoral era del tipo cromofóbico, sin embargo la gran mayoría de los estudios realizados fueron hechos con microscopía de luz convencional, por lo cual únicamente reflejan las características histológicas de tinción. Los estudios más recientes de tipo inmunohistoquímico y de microscopía electrónica, los cuales conforman la clasificación histológica actual señalan que la variedad más frecuente de macroadenomas es la de tipo no productor de hormonas, seguida de los prolactinomas8.
|
|
|
| Células nulas 52 |
52
|
| Prolactina |
17
|
| Gonadotrópico |
13
|
| Hormona del crecimiento |
9
|
| Corticotropina |
9
|
Tratamiento
1. Quirúrgico
La presencia de oftalmoplejia secundaria al compromiso de uno o más nervios oculomotores por si misma no es indicación de cirugía inmediata28 .
El estatus del nervio óptico puede ser un factor pronóstico con respecto al resultado de la cirugía tal como lo señala Mc Fadzean28, pues su atrofia representa una mayor vulnerabilidad preexistente al episodio apopléjico.
Por otra parte Arafah y colaboradores señalan que una descompresión quirúrgica relativamente temprana ofrece la posibilidad de rescatar infundíbulo y tejido hipofisiario normal que ha sido desplazado por el adenoma36.
La experiencia en general de la cirugía urgente para la resolución de déficits hemisféricos secundarios a la oclusión de la A. Carótida interna o de alguna de sus ramas ha sido uniformemente pobre15.
Son raros los reportes donde se describa agravamiento de los déficits secundario al procedimiento quirúrgico11.
Algunas de las indicaciones
de la hipofisectomía transcraneal se detallan en el cuadro 9.
La gran mayoría de las series advocan la descompresión por vía transesfenoidal debido a su mejor tolerancia y poca morbilidad asociada. Algunas variantes del procedimiento transesfenoidal clásico incluyen la aspiración estereotáxica con aguja descrita por Berti47 y colaboradores en 1971 y por Zervas48 y colaboradores en 1975.
La introducción del endoscopio a la cirugía de la hipófisis tiene sus antecedentes en la cirugía endoscópica funcional de los senos paranasales. En 1989 Papay49 y colaboradores reportaron la reparación endoscópica de una fístula postoperatoria de LCR y a partir de esta experiencia, en 1992 Jankowski50 reporta su experiencia en tres pacientes a quienes se les realizó hipofisectomía. Recientemente esta técnica se ha popularizado con base a la simplicidad de la técnica, mejor exposición y menor disección de tejidos durante el acceso a la región selar (Véase fig.4).
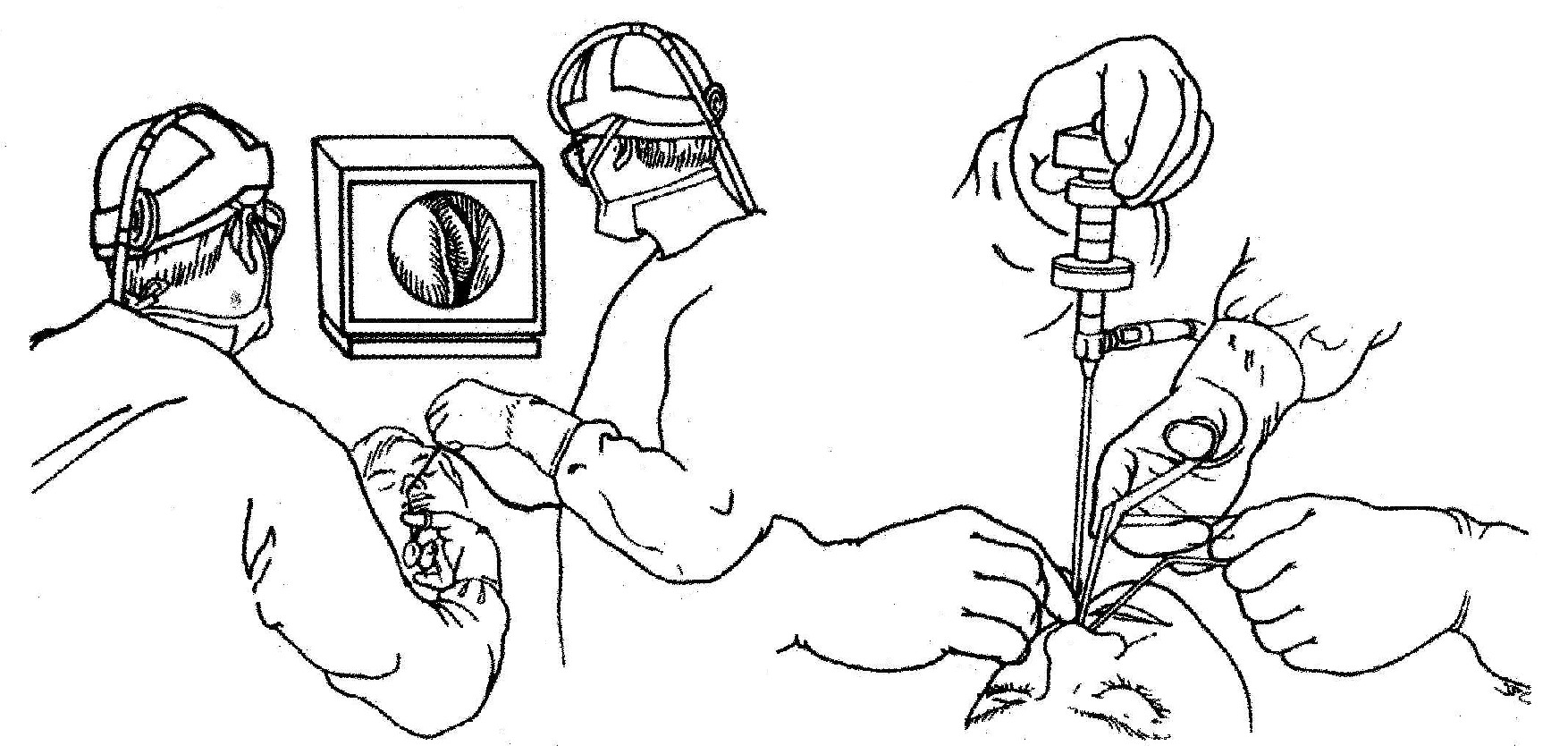
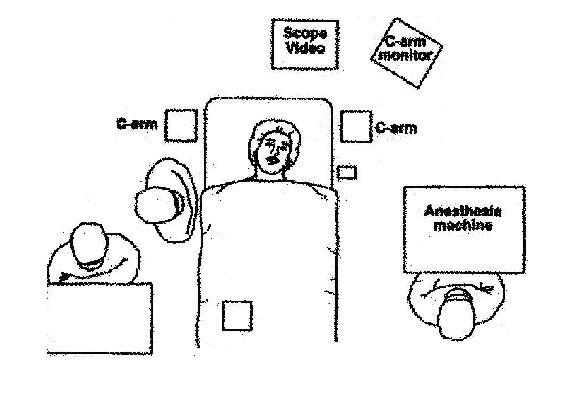
La distribución dentro de la sala de operaciones se dispone de tal forma que sea factible la introducción de un intensificador de imágenes fluoroscópicas.
En la fig.
5 se ilustra la distribución del personal alrededor del paciente.
Es de fundamental importancia la preparación preoperatoria del aspecto lateral del muslo derecho para obtener injertos de músculo, fascia y grasa subcutánea los cuales serán utilizados durante el cierre del seno esfenoidal.
En nuestra institución se utilizan 200 mg de clorhidrato de cocaína diluidos en 20 cc de solución fisiológica, los cuales se aplican a la mucosa endonasal con la ayuda de cotonoides.
Posteriormente se inyecta el septum membranoso y óseo en forma bilateral así como la porción distal del septum cartilaginoso con lidocaína.
Se aplica yodo a la cara del paciente y se viste de manera habitual. Posteriormente se realiza una incisión de hemitransfixión en el extremo caudal del cartílago septal (Fig. 6).
Se realiza una disección mucopericondrial separando la mucosa del septum desde el plano perpendicular hasta el etmoides y de ahí en sentido posterior hasta descubrir el rostrum esfenoidal el cual se abre con fresa neumática o con la ayuda de un osteotomo (Figs. 7 y 8).
La apertura de la pared anterior se amplía con instrumento de Kerrison. Una vez retirada la mucosa del seno esfenoidal se visualiza el piso selar el cual es abierto de forma semejante.
La hipofisectomía se realiza de la manera habitual empleando pinzas de biopsia y curetas de Ray de diversas angulaciones. Se realiza curetaje bajo visión fluoroscópica para determinar la extensión de la resección.
Una vez realizada la hipofisectomía, se coloca taponamiento de facia y grasa que se mantiene en su sitio con un taponamiento de gasa convencional.
Rovit35 ha señalado que la extensión de la resección transesfenoidal se encuentra condicionada a las dimensiones del tumor y al estado clínico del paciente. Por lo tanto, es factible realizar resecciones subtotales, siempre y cuando se descompriman en forma adecuada y suficiente los nervios ópticos y los compartimentos selares laterales.
En la resección de lesiones residuales puede volver a utilizarse la vía endoscópica transesfenoidal ya que muchas lesiones que se encontraban por arriba del diafragma, tras haber pasado algún tiempo, descienden hacia la cavidad selar. El resto de lesiones pueden abordarse por vía intracraneal según sea necesario.
Los pacientes se manejan habitualmente con destete respiratorio temprano y terapia de reemplazo hormonal utilizando hídrocortisona intravenosa.
En el momento que el sensorio del paciente permite su alimentación por vía oral se traslapa el tratamiento oral de hidrocortisona y levotiroxina de acuerdo a los requerimientos de cada paciente.
Cabe mencionar que algunos pacientes pueden requerir la colocación de un sistema de derivación externa de LCR que se retira una vez que el proceso inflamatorio de las cisternas basases ha cedido así como la disfunción transitoria en la función de absorción de las granulaciones de Paccioni. Excepcionalmente se requiere de un sistema permanente de derivación ventrículoperitoneal.
2. Tratamiento Médico
Tal como se ha visto, el cuadro de apoplejía hipofisiaria se asocia frecuentemente a insuficiencia suprarrenal y trastornos hidroelectrolíticos producto de la disfunción del eje hipotálamo- hipofisiario11,12,15,28,29,43,47. Varios autores recalcan la importancia de iniciar en forma temprana la administración de hidrocortisona por vía endovenosa una vez que se han tomado muestras de suero para determinar el estado de la reserva hipofisiaria. Una vez que el paciente se ha estabilizado desde el punto de vista médico, puede procederse a la descompresión quirúrgica.
3. Radioterapia
Esta variedad de tratamiento
se reserva únicamente a aquellos pacientes cuya condición
médica impide la realización del procedimiento quirúrgico15, 30,35.
Reporte de casos
Caso 1
Paciente del sexo masculino
de 57 años de edad, con dislipidemia sin tratamiento como único
antecedente médico de importancia, quien inicia con cuadro de tres
días de evolución manifestado por cefalea intensa asociada
a nausea y vómitos de contenido gástrico que posteriormente
dan paso a febrícula y disminución progresiva de la agudeza
visual en el ojo izquierdo. El paciente es valorado en un hospital
periférico, donde se le realiza una tomografía axial con medio
de contraste y es referido a este centro para su valoración neuroquirúrgica
(Véase Fig 9). A su ingreso al servicio
de emergencias se le documenta amaurosis del ojo izquierdo asociada a quemosis
bilateral y la cual a lo largo de las siguientes 12 horas progresa a amaurosis
bilateral, parálisis bilateral de nervios oculomotores y trocleares
con preservación de la abducción bilateral, fiebre cuantificada
en 40o C y desorientación. Los resultados de laboratorio
reflejaron una tendencia a la hemoconcentración con Hemoglobina
de 17.1, hematocrito de 52%, leucocitosis relativa de 16200 con 80% de
segmentados y 17% de linfocitos. Las pruebas de coagulación
se encontraron dentro de límites normales así como el perfil
bioquímico. Los resultados hormonales pre y postoperatorios
se muestran en la tabla 10.
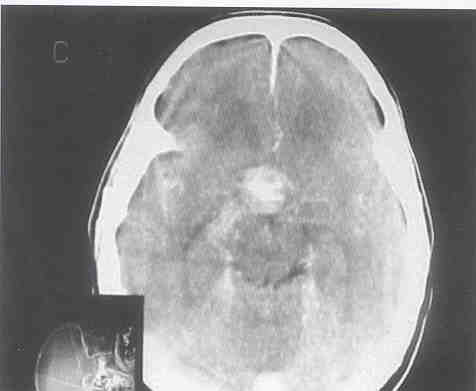
Se le realizó Resonancia Magnética con gadolinio como medio de contraste en la cual se documentan imágenes que en las diversas secuencias demuestran la presencia de expansión de la silla turca a expensas de un tumor con extensión hacia los senos etmoidales y esfenoidal el cual muestra heterogeneidad en su interior compatible con zonas de hemorragia e infarto que condicionan aumento de volumen en sentido lateral con compresión de los compartimentos selares laterales (senos cavernosos) Véase fig. 10.
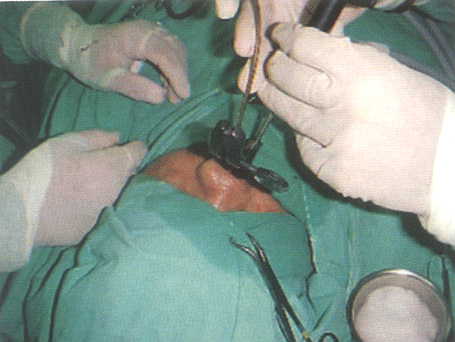
Se le inició terapia de sustitución con hidrocortisona y se llevó a sala de operaciones realizándose una hipofisectomía transesfenoidal con la ayuda del endoscopio (Figs. 12 y 13).
Durante el postoperatorio se documentó la adición de la parálisis del nervio abducens derecho a la Oftalmoparesia descrita anteriormente así como la ausencia de recuperación de la amaurosis bilateral. A lo largo de 7 días el paciente tuvo mejoría evidente de la motilidad extraocular con recuperación de la función del nervio oculomotor derecho y de los nervios oculomotor y troclear izquierdos. Fue egresado sin complicaciones adicionales tomando terapia de reposición con hidrocortisona 20 mg /am + 10 mg/pm y levotiroxina 0.15 mg/día. Su diabetes insípida resolvió progresivamente sin requerir desmopresina.
En la cita de seguimiento un mes después de la cirugía se documentó la persistencia de la amaurosis bilateral con recuperación completa de la motilidad extraocular.
El reporte histopatológico describió extensas áreas de necrosis interpuestas entre células neoplásicas de citoplasma eosinofílico con núcleos redondos homogéneos con cromatina dispersa. La inmunohistoquímica reveló ausencia de expresión de hormonas por lo cual se le catalogó como adenoma hipofisiario de células nulas.
| Hormona |
Paciente 1 preoperatorio |
Paciente 1 postoperatorio 6m |
Paciente 12 preoperatorio |
Paciente 2 postoperatorio 6m |
| Cortisol |
90 | 34.3 |
261 |
158 |
| Prolactina |
10.6 |
10.6 |
10.6 |
10.9 |
| TSH |
0.37 |
0.10 |
1.6 |
0.20 |
| T3 |
1.1 |
0.64 |
1.8 |
|
| T4 |
16.1 |
20.2 |
8.9 |
14.3 |
| Crecimiento |
3.2 |
0.13 |
0.13 |
0.13 |
| Testoterona |
0.7 |
0.7 |
1.6 |
Se le realiza tomografía axial computadorizada la cual evidencia un aumento de la densidad del contenido de la silla turca, sin evidencia de sangre en el espacio suaracnoide u otras imágenes patológicas en el resto del estudio Véase Fig. 12 posteriormente se repite el estudio utilizando medio de contraste yodado donde se pone en evidencia la presencia de un tumor selar con erosión selar y una cápsula que alberga diversas densidades sugestivas de necrosis y hemorragia en su interior. Véase Fig. 13


El paciente prosigue con deterioro
del sensorio por lo cual se decide intubar, iniciar medidas antiedema e iniciar
medidas de reposición hormonal. Cursa con hipotensión
que requiere soporte vasopresor con dopamina, se inicia terapia de sustitución
con hidrocortisona y se hace necesaria la utilización de desmopresina
por la instalación de diabetes insípida. El paciente
presenta midriasis bilateral y hemiparesia izquierda de predominio faciobraquial.
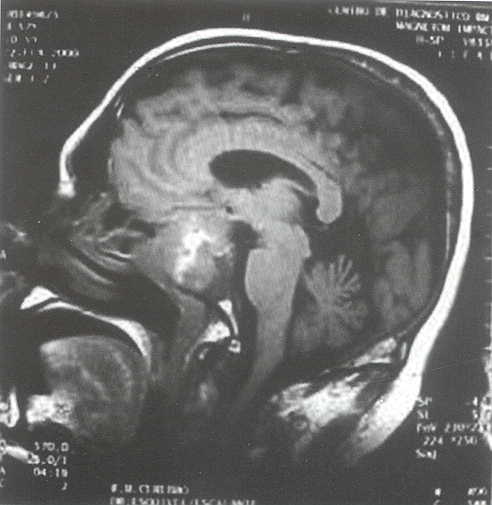
Se le realizó resonancia magnética con gadolinio como medio de contraste en la cual se documenta en las diversas secuencias la presencia de expansión de la silla turca a expensas de un tumor selar con extensión hacia los senos etmoidales y esfenoidal la cual muestra heterogeneidad en su interior compatible con zonas de hemorragia e infarto que condicionan aumento de volumen en sentido lateral con compresión de los compartimentos selares laterales (senos cavernosos) (Véase Fig 16).
Una vez que el paciente ha estabilizado su estado hemodinámico 72 horas posteriores a su ingreso se decide llevar a sala de operaciones donde se le realiza una hipofisectomía transesfenoidal con ayuda del endoscopio la cual evidencia la presencia de un tumor selar cuya consistencia es necrótico-hemorrágica.
El reporte histopatológico es compatible con tejido necrohemorrágico con escasos restos de tejido hipofisiario insuficientes para estudio inmunohistoquímico.
|

|

|

|
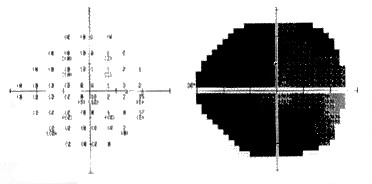
En la cita de seguimiento de seis meses se documenta resolución completa de la oftalmoparesia con persistencia de los déficit campimétricos tal como se muestra en la Figs. 18 y 19. El paciente refiere sentir dolor residual en los territorios correspondientes a la rama oftálmica de ambos nervios trigéminos. Las imágenes de tomografía axial computadorizada seis meses después de la cirugía evidencian ausencia de tumor residual.
En la figura 20 se demuestra la recuperación total de movimiento de los músculos extraoculares.

Discusión
La apoplejía hipofisiaria es un padecimiento infrecuente que requiere de un alto índice de sospecha clínica11,12,14,21,28,34,42,43. La presentación de trastornos de la agudeza visual asociados a oftalmoparesia y dolor orbitarlo hace que su diagnóstico sindrómico se simplifique. La introducción de las nuevas técnicas de diagnóstico por imagen corroboran en la presencia de lesiones selares con hemorragia o infarto recientes45,46. Una vez que se ha iniciado la terapéutica médica de soporte y se han obtenido mediciones basales de las hormonas hipofisiarias, se deberá proceder a realizar descompresión transesfenoidal del contenido selar10,11,12,13,15.
El concepto de cirugía de mínima invasión se deriva de la combinación dada en la introducción de instrumental de alto desarrollo tecnológico con un detallado conocimiento de los diversos espacios anatómicos. Su objetivo es la realización de procedimientos terapéuticos con una mínima manipulación de las estructuras anatómicas vecinas al proceso patológico52 . Dentro de la cirugía de la glándula hipofisiaria, el concepto ha evolucionado desde la primera resección realizada por Schloffer a través de una vía superolateral transesfenoidal53, hasta la introducción de la técnica clásica transefenoidal sublabial transeptal por Harvey Cushing54 quien realizó aproximadamente 250 procedimientos, hasta que decidió abandonar el procedimiento, favoreciendo los abordajes intracraneanos que le permitían ampliar la posibilidad de resección en este tipo de lesiones, especialmente en el caso de los macroadenomas con extensión supraselar asimétrica así como abordar otras lesiones de la región paraselar dadas las limitaciones de la técnica neurorradiológica en el primer cuarto del siglo pasado. Norman Dott, neurocirujano de Edimburgo, prosiguió empleando la técnica transesfenoidal y refinando el instrumental53. Cuando Gerard Guiot visitó dicho centro, Dott tuvo la visión de señalar el camino al decirle "Creo que usted debe desarrollar el instrumental y mejorar la técnica quirúrgica de la hipofisectomía transesfenoidal". En efecto, Guiot regresa a Paris donde se dedicaría a refinar el procedimiento, popularizándolo en Europa. Jules Hardy de Montreal reintroduce la técnica en Norteamérica tras haber sido alumno de Guiot y sienta los estándares de la técnica microneuroquirúrgica al introducir el microscopio quirúrgico y la fluoroscopía transoperatoria53. Las técnicas de mínima invasión o de abordaje por cerradura (del inglés, Keyhole approach) tienen su cuna en Alemania en manos del Profesor Axel Pemeczky52 quien introduce el concepto de neurocirugía de mínima invasión al emplear endoscopios para desplazarse dentro de los espacios de las cisternas subaracnoideas. El objetivo último de esta técnica es "la maximización de resultados quirúrgicos con una minimización de daño a las estructuras neurales adyacentes".
La técnica endoscópica para la resección de tumores de la hipófisis ha ganado adeptos particularmente dentro de los diez últimos años. Hasta el momento desconocemos la existencia de otro reporte de manejo de apoplejía hipofisiaria a través de técnica endoscópica. Creemos que la justificación del procedimiento radica en la simplicidad del mismo una vez que el cirujano se ha familiarizado con la técnica endoscópica transesfenoidal. El traumatismo quirúrgico es minimizado, abreviando el tiempo quirúrgico y la descompresión se realiza en forma suficiente bajo visión directa. Al igual que con la técnica transefenoidal clásica, existe evidencia que señala que dicha descompresión puede ser realizada sin necesidad de resecar la totalidad del tumor en un primer tiempo quirúrgico15, esperando que la condición clínica del paciente mejore con la sustitución hormonal para posteriormente ser reintervenido bajo condiciones mas apropiadas.
Una ventaja de esta técnica reside en su simplicidad y en la posibilidad de transformar esta vía de abordaje en un procedimiento clásico con un mínimo de tiempo extra de ser esto necesario.
Jho ha señalado entre las ventajas de este procedimiento una menor incidencia de complicaciones infecciosas derivadas de las regiones dental, nasal, septal y paranasal, así como un mejor manejo postoperatorio ya que se traumatizan menos los tejidos faciales y si no ha habido necesidad de trabajar por arriba del diafragma selar, la ausencia de taponamiento nasal55.
Este mismo autor señala que la visualización panorámica del seno esfenoidal facilita la resección de lesiones tumorales ya que es más fácil distinguir la interfase entre tejido patológico y tejido hipofisiario normal. Adicionalmente la visión endoscópica del seno esfenoidal detalla con gran exactitud las protuberancias ópticas, carotídeas, los recesos opticocarotídeos y la indentación del clivus lo cual minimiza la posibilidad de producir lesiones a dichas estructuras con resultados catastróficos.
Es importante
señalar que la cirugía endoscópica de la región
hipofisiaria no viene a desplazar el procedimiento microneuroquirúrgico
clásico realizado con microscopio, sino que enriquece y complementa
la técnica añadiendo nuevas posibilidades de manejo.
Referencias
1. Bailey
P: Pathological report of a case of akromegaly with special reference lo
the lesions of the hipophysis cerebri and in the thyroid gland; and a case
of hemorrage into the pituitary. Philadelphia Med J 1: 789-792, 1898.
2. Bleibtreu L: Ein Fall von akromegalie (Zerstörung der Hipophysis durch Blutung). Munch Med Wochenschr 52:2079-2080, 1905.
3. Brougham M, Heusner AP, Adams RD: Acute degenerations in adenomas of the pituitary body - with special reference lo pituitary apoplexy. J Neurosurg 7:421, 1950.
4. Sheehan HL, Murdoch R: Postpartum necrosis of the anterior pituitary: Pathologycal and clinical aspects. J Obstet Gynaecol Br Emp 45:456-488. 1938
5. Sheehan HL, Stansfield JP: The pathogenesis of postpartum necrosis of the anterior lobe of the pituitary gland. Acta Endocrinol 37:479-510, 1961.
6. Cooperman D, Malarkey WB: Pituitary apoplexy. Heart Lung 7, 450-454.1978.
7. Conomy JP, Ferguson JH, Brodkey JS el al: Spontaneous infarction in pituitary tumors. Neurologic and therapeutic aspects. Neurology 25,580-587, 1975.
8. Thapar K, Kovaks K, Horvath E. Classification and pathology of pituitary tumors. In Wilkins RH, Rengachary SR eds. Neurosurgery. Second edition, Mc Graw Hill, New York 1996,1273-1289.
9. Yamada S, Sano T. Neuropathology of the Pituitary. In Neuroendocrinology. Volume 5 Current Concepts in Neurosurgery. The Congress Of Neurological Surgeons, Baltimore 1992, 289-335.
10. Lopez IA: Pituitary Apoplexy, J Oslo City Hosp 20:17. 1970.
11. Wakai S, Fukushima T, Teramoto A, Sano K. Pituitary Apoplexy: Its incidence and clinical significance. J Neurosurgery 55:187, 1981.
12. Muller-Jensen A, Ludecke D: Clinical aspects of spontaneous necrosis of pituitary tumors (pituitary apoplexy). J Neurol 224:267, 1981.
13. Mohr G, Hardy J, Comtois R, Beauregard H: Surgical management of giant pituitary adenomas. Can J Neurol Sci 17:62, 1990.
14. Glick RP, Tiesi JA. Subacule pituitatry apoplexy: clinical and magnetic resonance imaging characteristics. Neurosurgery 27:214-217, 1990.
15. While W Sing S. Pituitary apoplexy. In Carter P, Spetzler R, eds. Neurovascular Surgery. McGraw Hill, New York 1995, 497-519.
16. Alhajje A, Lambert M, Crabbe J: Pituitary apoplexy in an acromegalic patient during bromocriptina therapy. J Neurosurg 63:288, 1985.
17. Daniel PM, Pritchard MAIL, Treip CS: Traumatic infarction of the anterior lobe of the pituitary gland. Lancet 2:927, 1959.
18. Holness RO, Ogundimu FA, Langille RA: Pituitary apoplexy following closed head trauma. Case report. J Neurosurg 59:677, 1983.
19. Nourizadeh AR, Pitss FW: Hemorrage into pituitary adenoma during anticoagulant therapy. JAMA 193:623, 1965.
20. Dawson BH, Kothandaram P: Actile massive infarction of pituitary adenomas. A study of five patients. J Neurosurg 37:275, 1972.
21. Rosenbaum TJ, Houser OW, Laws ER: Pituitary apoplexy producing internal carotid artery occlusion. Case report. J Neurosurg 47:599, 1977.
22. Cohen AR, Cooper PR, Kupersmith MJ, et al.: Visual recovery after transsphenoidal removal of pituitary adenomas. Neurosurgery 17:446, 1985.
23. Kovacs K: Adenohypophyseal necrosis in routine autopsies. Endokrinologie 60:309-316, 1972.
24. Schalch DS, Burday SZ: Antepartum pituitary insufficiency in diabetes mellitus. Ann Intern Med 74:357-360, 1971.
25. Pastore RA, Anderson JW Herman RH: Anterior and posterior hypopituitarism associated with sickle cell trail. Ann Intern Med 71:593-598, 1968.
26. Daniel PM, Spicer EJF Treip CS: Pituitary necrosis in patients maintained on mechanical respirators. J Pathol 111:135-138, 1973.
27. Gorczyca W Hardy J.- Microadenonzas of the human pituitary and their vascularization. Neurosurgery 22:1, 1988.
28. Mc Fadzean RM, Doyle D, Teasdale G. Pituitary apoplexy and its effects on vision. Neurosurgery 29:5. 199I.
29. Onesti ST Wisniewsi T, Post KD: Clinical versus subclinical pituitary apoplexy. Presentation, surgical management, and outcome in 21 patients. Neurosurgery 26:980, 1990.
30. Laws ER, Ebersold MJ: Pituitary apoplexy- an endocrine emergency. World J Surg 6:606, 1982.
31. Hicksteín DD, Chandlet WF: Marshall JC: The spectrum of pituitary adenoma hemorrage. West J Med I44:433, 1986.
32. Tsitsopoulos P, Andrew J, Harrison MJG: Pituitary, apoplexy and hemorrage into adenomas. Postgrad Med J 62:623, 1986.
33. Rachlin JR, Wilson CB, Hoyt W. Norman D: Pituitary apoplexy: A review of surgical results in 32 cases. Presented at annual meeting, American Association (of Neurological Surgeons, Washington, D. C: 1989.
34. David NJ. Gargano FP, Glazer JS: Pituitary apoplexy in clinical perspective, in Glaser TS, Smith JL (eds): Neuroophtalmology, VII. St Louis, Mosby I975, pp 140-165.
35. Rovit RL. Pituitary apoplexy. In Wilkins RH, Rengachary SR eds. Neurosurgery. Second edition, Mc Graw, Hill, New York 1996, 1361-1366.
36. Arafah BM, Harrington JF Maldhoun ZT. Improvement of pituitary function after surgical decompression for pituitary apoplexy. J Clin Endocrinol Metab 71:323, 1990.
37. Patel Dv, Shields MC. Intraventrícula hemorrage in pituitary apoplexy. Case report. J Comput Assist Thomogr 3:829, 1979.
38. Poisson VI, Effentere Rv, Mashaly R. Pituitary apopleyy with retraction nistagmus. Arch Neurol 7:286, 1980.
39. Locke S, Tyler HR: Pituitary apoplexy. Report two cases with pathological verification. Am J Med 30:643, 1961.
40. Jacobi JD, Fishman LM, Daroff RB. Pituitary apoplexy in acromegaly followed by partial pituitary insufficiency. Arch Intern Med 134:559, 1974.
41. Jolley FL, Mabon RL. Pituitary apoplexy. J Med Assoc Ga 47:75, 1958.
42. Cardoso ER, Peterson EW. Pituitary apoplexy. A review. Neurosurgery 14: 363, 1984.
43. Bills,D.C, Meyer M.D., et al, A retrospective analysis of pituitary apoplexy. Neurosurgery, 33:4 1993.
44. Ebersold
MJ, Laws ER, Scheithauer BW. Outuitary apoplexy treated by transsphenoidal
surgery. J Neurosurg 58:315-320.1983.
45. White
W. Wallace RC: Neuroradiologic evaluation of pituitary tumors.
Contemp Neurosurg 14:1, 1992.
46. Grossman BC. Magnetic resonance imaging and computed tomography of the head and spine Williams & Wilkins, Baltimore 1996.
47. Berti G, Heisey WG, Dohn DF: Pituitary apoplexy treated by stereotactic transsphenoidal aspiration. Cleve Clin Q 41:163. 1974.
48. Zervas NT Mendelson G: Treatment of acute hemorrage of pituitary tumors. Lancet 1:604, 1975.
49. Papay FA, Benninger MS, Levine HL. Transnasal transeptal endoscopic repair of sphenoidal cerebral spinal fluid fistula. Otoryngol Head Neck Surg 101:595-7, 1989.
50. Jankowsky R, Auque J, Simon C. Endoscopic pituitary tumor surgery. Laryngoscope 102:198-202, 1992.
51. Reid RL, Quigley ME, Yen SC. Pituitary apoplexy, A Review Arch Neurol.42:712, 1985.
52. Grotenhuis JA. Endoscope assisted microneurosurgery, a concise guidebook. Nijmegen, Machaon, 1998, 14-17.
53. Hardy J Trans-sphenoidal approach to the pituitary gland In: Wilkins RH, Rengachary SS, eds. Neurosurgery. New York: McGraw-Hill Book Co, 1996 1375-1384.
54. Rosegay H. Cushing´s legacy lo transsphenoidal surgery. J, Neurosurgery 54:448-56, 1981.
55. Jho H.D.,
Carrau R.L, Ko Y el al. Endoscopic pituitary surgery: An early experience.
J, Neurosurg 47:213-23, 1997.
*Servicio de Neurocirugía, Hospital Dr. Rafael Calderón Guardia, Caja Costarricense de Seguro Social, San José, Costa Rica