ARTÍCULO
DE TÉCNICA QUIRÚRGICA
Aneurismas de MI.
Anatomía microquirúrgica.
Estrategia quirúrgica
"MI Aneurysms. Microsurgical
anatomy. Surgical Strategy"
Dr. Manuel S. Gadea N., Dr. Femando
González S., Dr. Francisco Saborío V, Dr. Carlos Cabezas
C., Dr. Teodoro Evans B.*
Artículo
recibido: 21-8-2000 - Aprobado: 3-8-2001
Abstract
Middle
cerebral artery aneurysms comprise 20% of all intracranial aneurysms, those
located at the MI segment between 2 and 10% of the cases. The middle
cerebral artery is one of the intracranial arteries who present with great
variants in both, its course and its morphometry, that's why for the neurovascular
surgeon is to important on having a geat knowledge in its microsurgical
aspects, variations, and types of approaching these lesions.
In spite of the great advances in microsurgical techniques, skull base
surgery, and neuroanesthesia, the morbimortality remain still high.
Key words: middle cerebral artery, aneurysm, microsurgery, surgical
strategy.
Resumen
Los
aneurismas de la arteria cerebral media (ACM) comprenden el 20% de todos
los aneurismas intracraneanos; aquellos localizados en el segmento MI, entre
el 2 y el 10% de los casos. La ACM es una de las arterias cerebrales
que presentan más variantes, tanto en curso, como en su morfometría,
por lo que para el cirujano neurovascular es muy importante el tener un
conocimiento importante de los aspectos microquirúrgicos, variantes
y tipos de abordajes a estas lesiones.
A pesar de los grandes adelantos en las técnicas microquirúrgicas,
cirugía de base, neuroanestesiología, la morbi-mortalidad
continúa siendo alta en estas lesiones.
Palabras claves: arteria cerebral media, aneurisma, microcirugía,
estrategia quirúrgica.
Introducción
Los
aneurismas de la arteria cerebral media (ACM) son relativamente frecuentes,
comprendiendo un 20% del total de las lesiones intracraneanas (1, 2). A nivel de la ACM, los aneurismas
del segmento MI tienen una incidencia entre 2% y 10% según las diferentes
series (1, 2, 3, 4, 5, 6).
Debido a la variabilidad
en la longitud de MI y a la configuración anatómica del valle
silviano, estos aneurismas poseen dificultades particulares. Para
su localización quirúrgica en comparación con otros
del circuito anterior.
La mayoría
de los pacientes con aneurismas del MI se presentan con cuadros de hemorragia
subaracnoidea (HAS); existen algunos datos clínicos los que favorecen
el diagnóstico de esta localización, uno de éstos,
la pérdida transitoria del estado de despierto al momento de la ruptura,
lo que ocurre hasta en un 60% de los casos; otra característica clínica
de la ruptura de estos aneusimas es la cefalea, la que usualmente es hemicraneal
e ipsilateral al sitio del ictus. Dependiendo de la proyección
del saco aneurismático, éstos se pueden presentar con un
cuadro de epilepsia temporal. Los aneurismas de la ACM pueden presentarse
como episodios isquémicos transitorios reversibles (AIT), más
frecuentemente que en otras localizaciones (7).
Estos aneurismas
se asocian más que en ninguna otra localización a hematoma
parenquimatoso (49.8%); en algunas series la incidencia alcanza hasta un
75% de los casos (8, 9). Comparativamente,
los aneurismas de la arteria carótida interna se asocian a hematoma
parenquimatoso en 15.8% y los del complejo cerebral anterior-comunicante
anterior-recurrente de Huebner en 20.2% de las veces (8).
Esta es otra de las causas de las crisis convulsivas en estos pacientes.
A
pesar de la preferencia de otros autores (10, 11). Para abordar algunas de estas lesiones a través
de una vía transcortical, nosotros preferimos el trans-silviano y
de éstos, el proximal o transsilviano medial (12,
13, 14, 15, 16, 17, 18, 19, 20, 21).
Anatomía
microquirúrgica
El
valle silviano es el "contenedor anatómico" de la mayor parte de
la ACM. A nivel de bifurcación carotídea, el segmento
proximal de MI está cubierto por gruesas fibras aracnoideas, representando
una "puerta" entre las cisternas carotídea y silviana. Estas
fibras conectan los giros fronto-orbitario y temporal. A menudo, una
vena anastomótica fronto-orbitaria corre sobre estas fibras desde
la sustancia perforada anterior (SPA) hacia la porción mesial del lóbulo
temporal. Distal a este punto, MI o segmento esfenoidal, penetra las
profundidades del valle silviano (22), cubierto por los
opérculos frontal y temporal, a través de estas fibras aracnoideas
laxas. El segmento MI corre adyacente a la SPA, posterior a la división
del tracto olfatorio, posterior y paralelo al ala esfenoidal. Según
Gibo et al (22), la primera porción del valle silviano
se denomina compartimento esfenoidal y contiene a MI, terminando en el límen
ínsula o rodilla. Los opérculos frontal y temporal forman
las paredes de este compartimento, yaciendo en yuxtaposición, paralelo
uno del otro; alternativamente uno de los opérculos (generalmente
el giro orbitario lateral del opérculo frontal) indenta al otro, encubriendo
la porción profunda de la cisterna y el segmento MI, al que se puede
considerar la continuación directa de la ACI; en el 70% de los casos
MI tiene mayor longitud que el segmento proximal de la arteria cerebral anterior
(ACA), oscilando entre 2.4 mm y 4.6 mm (1, 23), variando de un caso a otro considerablemente, dependiente
esto de sí la división principal es proximal o distal al límen
ínsulae; la división principal es proximal en un 86% de hemisferios
(22). Dependiendo de la longitud de la ACI, el segmento MI
proximal varía en profundidad en el valle, mientras que la profundidad
de la porción distal depende en forma individual de la configuración
del vaso. Angiográficamente, un rizo inferior prominente se
observa frecuentemente en el adulto y corresponde a una posición
superficial en el valle.
En
el compartimentto esfenoidal se originan varios casos del segmento MI: (a)
el grupo lateral inferior y (b) el grupo súpero-medial. Las
primeras, que toman su nombre por el sito de origen en la pared de MI son
las arterias uncal, témporo-polar y temporal anterior (generalmente
la más larga del segmento MI). La arteria uncal se puede originar
en la porción distal de la ACI y cuando sucede esto, la arteria témporo-polar
estará ausente o será hipoplásica; en otras ocasiones,
las arterias temporales se originan de un tronco común y muy pocas
veces nacen en la porción proximal de la bifurcación (MI-M2),
en el tronco temporal (inferior). Cuando la arteria temporal anterior
o el tronco temporal común son largos, pudieran dar la impresión
de una bifurcación temprana (psuedobifurcación). En casos
muy poco frecuentes, un tronco temporal común originado directamente
de la ACI, pudiera cofundirse con una ACM accesoria (22,
23, 24). Se debe también
tener presente que en un pequeño porcentaje de casos la arteria temporal
se origina de la pared ántero-superior de MI, corriendo en dirección
inferior hacia el opérculo temporal, formando un rizo.
El
grupo de vasos que se originan de la pared súpero-medial de MI son
las arterias lentículo-estríadas laterales (en número
variable) y ocasionalmente la arteria frontro-orbitaria lateral, la que
se origina en las proximidades de la bifurcación principal.
Es raro encontrar un tronco del que se originen las arterias estríadas
y la fronto-orbitraria lateral, pero cuando sucede, puede confundirse con
una falsa bifurcación de la ACM. Las arterias estríadas
laterales pueden dividirse en proximales y distales, de acuerdo al sitio
de origen a lo largo de MI (1, 25).
Roesner et al (26) han propuesto una división, la
que consideramos más descriptiva y apropiada; medial, intermedia y
lateral. El grupo intermedio posee la apariencia de un candelabro,
poseyendo al menos una "arteria mayor", con una compleja arborización
distal, mientras que los vasos del grupo lateral presentan una distribución
sinuosa (26). A lo largo de su recorrido las arterias
lentículo-estríadas penetran a través de las porciones
medial y posterior de la mitad lateral de la SPA (26),
irrigando la cabeza y el cuero del núcleo caudado, el segmento lateral
del globo pálido, la mitad superior de la cápsula interna y
la mayor parte del putamen (25, 26). En raras ocasiones,
un tronco fronto-orbitario-estríado se origina de la ACA, corriendo
paralelo y superior a MI, pudiéndose confundir también con
una ACM accesoria (1, 22, 27). La "verdadera" ACM accesoria se origina de la ACI
y cursa inferior al segmento MI. Cuando el origen de la ACM accesoria
están en relación con el de la ACA, su recorrido es superior
a MI.
El
segmento MI se bifurca a nivel del límen ínsulae, dando origen
a un tronco inferior (temporal) y uno superior (frontal). Estos troncos
se inclinan hacia atrás a lo largo del límen ínsulae
unos 90 grados y después de diverger en la bifurcación, convergen
en la profundidad del valle silviano, 1-2 cm distases a la bifurcación.
Mientras que el tronco frontal es más superficial, el tronco temporal
en su recorrido proximal se esconde debajo del opérculo temporal.
La parte del valle silviano distal al límen se conoce como porción
o compartimento opérculo-insular, siendo amplio y cubierto por venas
puente, las que se anastomosan con una o más venas témporo-esfenoidales.
De vez en cuando estas venas forman el grupo superficial de venas silvianas,
aunque una (y rara vez varias) vena silviana profunda se puede encontrar
en la corteza insular, adyacente y posterior al segmento MI distal y la bifurcación.
Las venas silvianas superficiales generalmente drenan hacia el seno esfeno-parietal
y rara vez hacia atrás a la vena de Labbé. La vena
silviana profunda drena a la basal de Rosenthal. El compartimento
opérculo-insular de la cisterna silviana. El compartimento
opérculo-insular de la cisterna silviana se divide en una fisura
orientada más superficial y horizontalmente (la hendidura opercular,
entre los opérculos en oposición, el fronto-parietal y el
temporal) y una fisura profunda vertical (la hendidura insular, perpendicular
a la hendidura opercular, entre la ínsula y el opérculo (3). La hendidura insular está compuesta por
una rama superior (entre la ínsula y el opérculo fronto-parietal)
y una rama inferior (entre la ínsula y el opérculo temporal).
La ramificación principal de la ACM se encuentra principalmente en
la hendidura insular, sobre la parte anterior de la ínsula, inmediatamente
distal a la rodilla. Las ramas distales de la ACM emergen a través
de la hendidura opercular. Para nutrir los lóbulos frontal,
temporal, parietal y occipital. Los vasos que se dirigen en sentido
superior sufren dos flexiones de 180 grados y aquellos de curso inferior,
siguen un trayecto menos tortuoso al salir del valle.
Estrategia quirúrgica
Los
aneurismas del segmento MI yacen en el valle silviano en su mayoría,
ya que una localización más periférico, fuera de él
es extremadamente rara. Como se menciona anteriormente, su baordaje
se realiza por vía trans-silviana, aunque algunos autores (10, 11) prefieren la
transcortical; básicamente la vía dependerá de la localización
y dirección del aneurisma, la asociación de hematoma, la
presencia de angiopatía vasoconstrictiva y otras condiciones (hidrocefalia,
síndrome de herniación uncal, etc.).
Cuando
se ha establecido el diagnóstico de aneurisma de MI, nosotros preferimos
y recomendamos un abordaje trans-silviano medial o proximal (9, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21). El resumen éste se
inicia de la bifurcación de la ACI, siguiendo la disección
en sentido distal, a lo largo del segmento MI, hasta identificar y disecar
el área proximal de la bifurcación de la ACM. Debido
a que antiguamente se traccionaba en sentido ascendente. Para alcanzar
el valle silviano proximal, a esta vía se le conocía erróneamente
como "subfrontal".
En los casos que
se operan en forma aguda, el acceso al valle silviano, no es fácil,
debiéndose realizar una apertura adecuada; en estos casos encontramos
coágulos adheridos a los aracnoides opercular, debiéndose
de evitar el penetrar el parénquima por debajo de la membrana aracnoidea,
hecho que sucede frecuentemente y sobre todo, si no se tiene experiencia.
Con un encéfalo turgente es difícil identificar superficialmente
la parte proximal del valle silviano, esto también es frecuente
cuando se superpone un opérculo sobre el otro. Sin embargo,
al identificar la aracnoides del valle, la apertura posterior se facilita.
A pesar de que las pequeñas venas puente se pueden sacrificar, las
más largas, localizadas sobre la parte distal del valle, deberán
de conservarse cuando sea posible.
La
profundidad del aneurisma en el valle es difícil de predecir y requiere
de la comprensión espacial de la arquitectura vascular, así
como de las estructuras óseas, de las cuales, la forma del ala esfenoidal
es la más importante. Hemos observado que en presencia de una
ACI larga, con bifurcación distal, MI se sitúa profundamente
en el valle, sin embargo, la profundidad de la porción distal de
MI dependerá de la configuración arquitectónica de la
totalidad del complejo de la ACM.
Es importante recalcar
que cuando el saco aneurismático se proyecta anteriormente o además
es alargado o gigante, yace superficialmente, algunas veces adherido a la
duramadre del ala esfenoidal; particularmente en estos caso es aconsehable
planear una vía distal o trans-silviana lateral, lo que permite abordar
el aneurisma desde atrás, teniendo el control de los troncos principales.
Durante un procedimiento
como éste, muy pocas veces se presta la debida atención al
sistema venoso; la oclusión de la vena silviana profunda puede traer
graves consecuencias, provocando un extenso infarto fronto-opercular, posiblemente
como resultado de retracción cerebral y particularmente en presencia
de pocas venas silvianas superficiales. Debido a que la oclusión
venosa es impredecible, la preservación de los troncos venosos mayores
es muy importante.
El abordaje de los
aneurismas de MI se relativamente complicado por la dirección vertical
de este segmento durante la intervención, obligando al cirujano a
una exposición oblicua desde una vista anterior. Estos aneurismas
se sitúan profundamente, especialmente cuando se proyectan en sentido
superior. Durante la disección del valle silviano proximal,
las pequeñas venas puente fronto-orbitrarias podrán sacrificarse.
Una vena fronto-orbitraria alargada, usualmente localizada sobre la bifurcación
carotídea, también podrá sacrificarse, sobre todo cuando
se ha planeado un "atrapamiento" temporal; esta estrategia es rutinaria
en aneurismas alargados, gigantes y aquellos raros aneurismas que se origina
en el nacimiento de las arterias uncal o frontopolar. En esta región
y con el fin de minimizar el trauma quirúrgico, es importante mantener
los límites de la disección en la aracnoides del valle silviano.
En la apertura progresiva del valle, el primer vaso que encontramos es la
arteria temporal anterior, que al seguirla, visualizamos el segmento MI,
el cual podemos exponer adecuadamente.
Cuando
el aneurisma se proyecta inferiormente o en sentido infero-anterior, generalmente
está rodeado por la arteria temporal anterior o la témporo-polar,
apuntando el saco del aneurisma hacia el cirujano. En este caso es
preferible primero exponer la porción distal de MI, luego identificando
el origen del aneurisma, desplazándose en sentido retrógrado
al flujo sanguíneo a lo largo del segmento MI y finalmente exponer
al porción proximal de MI, teniendo presente las posibles adherencias
del saco al opérculo y la localización superficial de algunos
de estos aneurismas en el valle. El aneurismas también puede
extenderse con su domo (saco) hacia el lóbulo temporal y entonces,
la aspiración de una pequeña cantidad de tejido será
necesaria antes de la colocación del clip definitivo. En todos
los casos, pero especialmente en aquellos en los que la arteria temporal
se encuentra alargada, simulando una bifurcación proximal de la ACM,
las ramas deberán de preservarse. Cuando el vaso está
totalmente oculto por el saco, se coloca un clip distal y accesible.
Para ser reposicionado cuando se logre visualizar adecuadamente el origen
del cuello del aneurisma. En forma alterna, cuando el saco es alargado,
se "atrapa" temporalmente la lesión, se depleta el saco y luego se
coloca el clip en el cuello. En algunas muy raras ocasiones, el saco
se proyecta en sentido postero-inferior, en esta situación, la rama
observada en el campo operatorio, sigue siendo la arteria temporal anterior,
el saco también puede tener adherencias
con
las arterias lentículo-estríadas y con la vena silviana profunda,
el clipamiento seguirá una estrategia semejante a la de la proyección
precedente.
Cuando
el aneurisma se proyecta en sentido superior o postero-superior, generalmente
se sitúa en el origen de un vaso lentículo-estríado
o en el origen del tronco común fronto-órbito-estríado.
En raras ocasiones la arteria temporal se origina de la pared superior de
M1; en este caso, el vaso envuelve al aneurisma, siguiendo su recorrido
hacia el lóbulo temporal. Lo usual es que el saco aneurismático
se dirija hacia o que de inmerso en la SPA, rodeado de vasos lentículo-estríados,
los que deberán de ser disecados cuidadosamente del cuello del aneurisma
antes de colocar el clip. El cuello del aneurisma puede estar oculto
por el mismo segmento MI; esta situación se da cuando el saco tiene
una verdadera proyección posterior y en estos casos es de gran ayuda
la utilización de clips fenestrados; obviamente, posterior a la colocación
del clip, es necesario una buena inspección del cuello, así
como de las porciones superior e inferior de MI. Alguna veces el
aneurisma se localiza en la porción distal de MI, en el origen de
la arteria fronto-orbitaria, teniendo adherencias extensas hacia los vasos
perforantes y la vena silviana profunda. Cuando las venas silvianas
superficiales son escasas o están ausentes, la profunda deberá
disecarse cuidadosamente, separarse y preservarse.
En
algunos pocos casos el aneurisma puede tener una proyección ántero-superior,
ocultando MI y el origen de las arterias lentículo-estríadas;
ante esta situación, el clip deberá de colocarse hasta visualizar
las ramificaciones y éste no deberá ocluirse hasta no tener
la certidumbre de no haber atrapado algún vaso en las hojas del clip.
Conclusiones
La
cirugía de aneurismas en MI requiere un total entendimiento de la
anatomía del área del valle silviano, de su cisterna, de las
ramificaciones de la ACM y de las proyecciones posibles del saco. Durante
el abordaje quirúrgico de estas lesiones se deberá de poner
especial cuidado en no provocar una ruptura prematura transquirúrgica
de aneurisma, adoptando para ello una estrategia tendiente a facilitar la
exposición de los vasos principales antes de manejar el saco.
En muchos de estos casos la colocación adecuada del clip es un proceso
secuencial, cuidadoso y demandante, principalmente en aneurismas alargados
o gigantes, o cuando M1 posee variantes anatomomorfométricas y/o está
rodeada de éstas. Un paso importante en esta cirugía
es la disección y separación sutil de las arterias lentículo-estríadas,
ya que las maniobras inadecuadas y/o bruscas terminarán en catástrofes
isquémicas.
Muchos pacientes
con aneurismas de MI tienen hematoma parenquimatoso asociado y una de las
metas de la estrategia, además de excluir el aneurisma, deberá
de ser la de evitar la turgencia postoperatoria. Cuando exista un
deterioro perioperatorio, deberá de investigarse y establecerse la
causa y resolverse ésta de inmediato.
El segmento MI es
la continuación directa de la ACI, haciendo un recorrido horizontal
en la porción esfenoidal del valle silviano; este recorrido alcanza
una longitud entre 14 y 16 mm, con un diámetro entre 3.5 y 4.5 mm,
transportando en promedio volúmenes de 120 a 170 cc por minuto.
Este segmento, proximal a la bifurcación, generalmente da origen
a ramas lentículo-estríadas mediales, las que nacen en la cara
dorsal, en oposición al origen de la arteria temporal anterior, dentro
de la cara lateral de la SPA. La rama temporal anterior se origina de
las superficies inferior y anterior, cursa en sentido anterior a través
de la porción superficial del valle silviano para adherirse a la
superficie anterior del lóbulo temporal. Estas estructuras contenidas
en la porción esfenoidal del valle son de la mayor importancia al
planear un abordaje para el tratamiento de aneurismas de MI.
Filosofía
neurovascular
Los
aneurismas de la ACM son los más superficiales que el cirujano puede
encontrar. A la profundidad a la que se debe trabajar es recomendable
utilizar instrumentos cortos, como los que empleamos en la cirugía
de by-pass. Dentro del armamentario es aconsejable contar también
con una pinza porta-clips corta.
Generalmente los
aneurismas de MI poseen angiográficamente cuellos anchos, lo que
plantea la duda de su "clipabilidad", recordando además que MI da
origen a ramas y arterias perforantes cercanas o íntimamente relacionadas
a la lesión; otros aneurismas de esta localización tienen
la apariencia imagenológica de no tener un cuello definido y es en
estos casos en particular en donde la experiencia y habilidad del cirujano
adquieren gran relevancia. Utilizar magnificación microquirúrgica
nos permitirá identificar plenamente el plano de clivaje que siempre
existe entre el aneurisma y el (los) vaso (s); al máximo, prácticamente
la totalidad de los aneurismas de MI podrán ser preparados para la
colocación del o los clips definitivo (s). Cuando esto no es
posible, existen otras alternativas terapéuticas como la reimplantación
arterias, el "atrapamiento" con bypass mediante procedimientos derivativos
con injertos venosos o los procedimientos reconstructivos microvasculares.
Como dato histórico
se puede mencionar el recubrimiento del aneurisma, método que a pesar
de provocar una reacción fibrovascular de cuerpo extraño,
no protege en el período perioperatorio agudo de una re-ruptura y
en el período crónico, a pesar de la cicatrización glial
que se produce, el riesgo de crecimiento y re-ruptura y en el período
crónico, a pesar de la cicatrización glial que se produce,
el riesgo de crecimiento y re-ruptura del aneurisma existe.
Casos ilustrativos
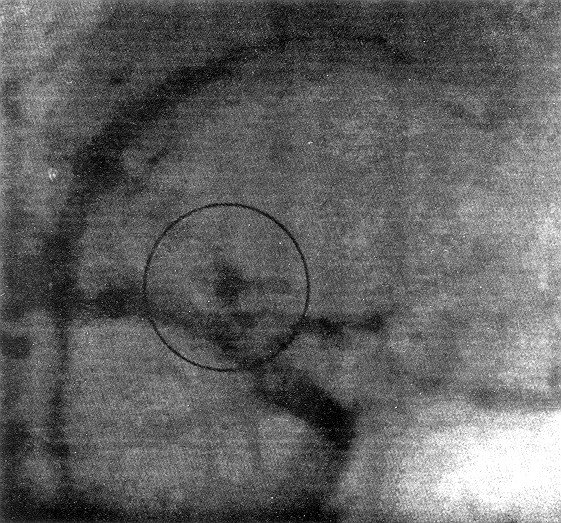
Caso 1: se trata de un paciente masculino de 37 años de
edad, diestro, sin factores de riesgo para enfermedad cerebrovascular,
quien ingresó al servicio con cuadro de HSA de 24 horas de evolución
le fueron realizados estudios complementarios para establecer el diagnóstico,
siendo intervenido quirúrgicamente, lográndose clipar la lesión.
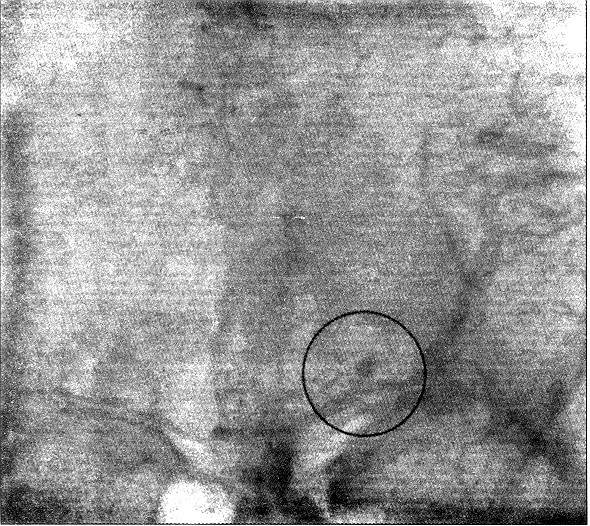
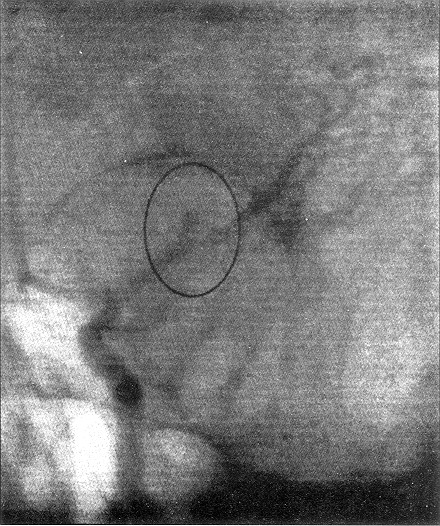
Caso 2:
paciente masculino de 33 años de edad, diestro, sin factores de riesgo
para enfermedad cerebrovascular, con cuadro ictal segerente de HSA tres días
previos a su ingreso. Fue estudiado, estableciéndose el diagnóstico
de aneurisma sacular de MI, lográndose clipar la lesión.
Tomografías
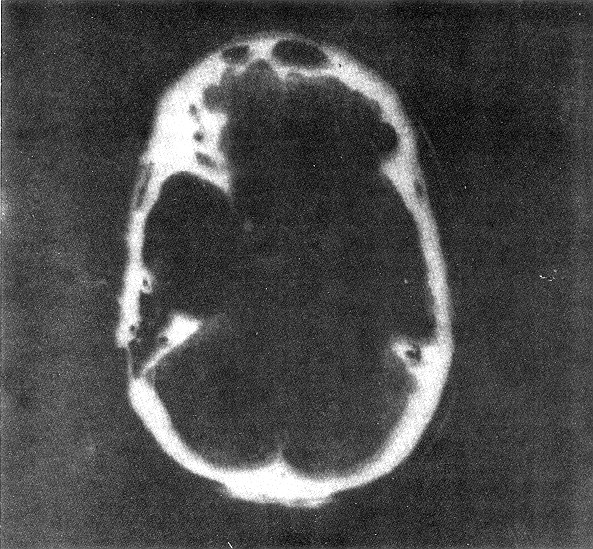 Caso 1
Caso 1
 Caso 2
Caso 2
Bibliografía
- Yasargil MG: Microneurosurgery. New York, Thieme-Stratton;
vol. II, 1984: 224-231.
-
Gadea NMS, Montiel RAE, Vázquez SH: Aneurismas
gigantes de la arteria cerebral media: experiencia en un hospital regional.
Arch. Neurocien. (Mex); 1999; 4, 4:215-218.
-
Flamm ES, Fein JM: Middle cerebral artery aneurysm.
In: Fein, JM, Flamm ES, eds.: Cerebrovascular surgery, New York, Springer-Verlag;
1985; 3: 861-877.
-
Rhoton AL, Jr, Saeki N, Perlmutter D, Zeal A: Microsurgical
anatomy of common aneurysm sites. Clin, Neurosurg. 1979; 26: 248-306.
-
Weir BK, Findlay JM, Disney L: Middle cerebral
artery aneurysm. In: Apuzzo MJ, ed: Brain surgery: complications,
avoidance and management. New York: Churchill Livingstone; 1993: 983-1008.
-
Hook 0, Norlen G: Aneurysms of the middle cerebral
artery. A report of 80 cases. Acta Chir Scand (Suppl) 1958;
235: 1-39.
-
Heros RC: Middle cerebral artery aneurysms.
In: Wilkins RH, Rengachary SS, eds.: Neurosurgery. New York, McGraw
Hill, 1985; 2: 1376-1383.
-
Lougheed VM, Marshall BM: Management of aneurysm
of the anterior circulation by intracranial procedures. In Youmans
JR, ed: Neurological surgery. Philadelphia, WB Saunders, 1973; 2: 742-750.
-
Gadea NMS: Aneurismas de la arteria cerebral media:
estrategias quirúrgicas. Rev. Mex Angiol 2000; 28 (1):
11–16.
-
Heros RC, Ojemann RG, Crowell RM: Superior temporal
gyrus approach to middle cerebral artery aneurysms: techniques and results.
Neurosurg. 1982; 10: 308-313.
-
Ojemann RG, Crowell RM: Middle cerebral artery
aneurysms. In: Ojemann RG, Crowell RM, eds: Surgical mangement of
cerebrovascular disease. Baltimore, Williams & Wilkins, 1983: 201-209.
-
Samson DS, Batjer HH: Intracranial aneurysm surgery:
techniques. Mount Kisko, NY: Futura Publishing; 1990: 83-95.
-
Kempe L: Operative neurosurgery. New York,
Springer-Verlag; 1968.
-
Peerles SJ: The surgical approch to middle cerebral
and posterior communicating aneurysm. Clin. Neurosurg. 1974;
21: 151-165.
-
Popen JL: An atlas of neurosurgical techniques.
Philadelphia: WB Saunders; 1960: 158-161.
-
Rand RW.- Microneurosurgery, 2 nd ed. St.
Louis: CV Mosby; 1978: 311-324.
-
Robinson RG: Ruptured aneurysms of the middle
cerebral artery. J. Neurosurg. 1971; 35: 25-33.
-
Shepard RH.- Operation for aneurysm of the middle
cerebral artery. In: Rob C, Smith R, eds: Operative surgery.
Fundamental International techniques, 3 id ed. London: Butterworth,
1979: 252-257.
-
Sugita K: Microsurgical atlas. New York:
Springer-Verlag; 1985
-
Sundt TM, Jr: Aneurysms of the anterior circulation.
In: Sundt TM, Jr: Surgical techniques for saccular and giant intracranial
aneurysms. Baltimore: Williams & Wilkins 1990: 179-212.
-
Suzuki J, Kodama N Fujiwara S., Ebina T.- Surgical
treatment of middle cerebral artery aneurysms: from the experience of 174
cases. In: Suzuki J, ed: Cerebral aneurysms Tokyo: Tokyo Press 1979:
278-283.
-
Gibo H, Carver CC, Rhoton AL, Jr Lenkey C, Mitchell
R: Microsurgical anatomy of the proximal segment of the middle cerebral
artery. J. Neurosurg. 1981: 54: 151-169.
-
Umansky F Montoya Juarez S, Dujovny M, et al:
Microsurgical anatomy of the proximal segment of the middel cerebral artery.
J. Neurosurg. 1984; 61: 458-467..
-
Grand W: Microsurgical anatomy of the proximal
middle cerebral artery and the internal carotid bifurcation. Neurosurg.
1980; 7: 215-218.
-
Umansky F Gomes FB, Duyovny M, et al: The perforating
branches of the middle cerebral artery. A microanatomical study.
J Neurosurg. 1985; 62: 261-268.
-
Rosner SS, Rhoton AL, Jr. Ono M, Barry M: Microsurgical
anatomy of the anterior perforating arteries. J. Neurosurg. 1984;
61: 468-485
-
Handa J, Shimizu Y, Matsuda M, et al.- The accessory
middle cerebral artery: report of further two cases. Clin. Radiol.
1970; 21: 415-416.
TODA CORRESPONDENCIA PUEDE SER ENVIADA A: Dr. Manuel
S. Gadea N., Servicio
de Neurocirugía. Hospital México.
*Servicio
de Neurocirugría. Hospital México. C.C.S.S


 }
}