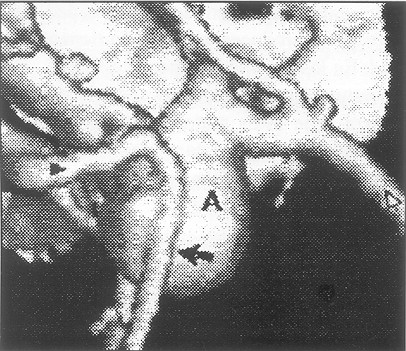
Aneurismas gigantes
Giant intracranial aneurysms: review article and presentation of seven patients
Artículo
recibido: 15 de febrero 2000 - Aprobado: 03 de marzo 2000
Abstract
This is a review article about giant intracranial aneurysms and a report of seven patients with this vascular disease between January and November of 1999 at Hospital Mexico, Department of Neurosurgery. They under went physical examination, CATSCAN, CEREBRAL ANGIOGRAPHY DIGITAL SUSTRACTED ANGIOGRAPHY and MAGNETIC RESONANCE IMAGING. Five of them presented as a subarachnoid haemorrhage, one asymptomatic and one as a pseudotumoral syndrome. Four were in the internal carotid artery, three but one clipped in three by direct surgical approach; two patients with an aneurysm of the basilar artery, one died, and one remain in stable condition. One in the middle cerebral artery, was clipped but died due to vasospasm and brain swelling. We discussed the surgical approach, secondary effects and outcome.
Key Words: Giant intracranial aneurysm, Circle of Willis, Turbulence, Surgical Approach, Endovascular therapy.
Resumen
Se presentan siete casos clínicos de aneurismas gigantes atendidos en el Servicio de Neurocirugía del Hospital México, entre enero y noviembre de 1999, estudiados por tomografía axial (TAC), resonancia magnética (IRM), angiografía convencional (AC) y angiografía digital sustraída (ADS). Cinco casos se presentaron con una hemorragia subaracnoidea, un caso fue diagnosticado por un TAC de rutina por trauma de cráneo y solo un caso presentó un síndrome pseudotumoral. Cuatro de ellos a nivel de la arteria carótida interna, dos en el sistema vertebro-basilar y uno en la arteria cerebral media que se operó y falleció por vasoespasmo y edema cerebral. Cuatro, recibieron tratamiento quirúrgico por abordaje directo de la lesión, tres de la arteria carótida interna y uno de la arteria cerebral media; uno de los pacientes con aneurisma de la basilar, falleció sin poder ser operado y dos están bajo vigilancia clínica. Sus abordajes quirúrgicos, complicaciones y evolución postoperatoria según el tipo de lesión. Se presenta una revisión de las conductas actuales sobre esta patología vascular cerebral.
Palabras Clave: aneurisma gigante, polígono de Willis, turbulencia, abordaje directo, terapia endovascular.
Introducción
Los aneurismas gigantes intracraneales representan un reto para el neurocirujano, tanto para el diagnóstico como para su tratamiento. Grandes avances se han alcanzado con la evolución de los métodos de diagnóstico desde la angiotomografía (ATAC), tomografía helicoidal (TACH), las imágenes por resonancia magnética (IRM) y la angiografía digital sustraída (ADS). El perfeccionamiento de las técnicas microquirúrgicas y endovasculares ofrecen posibilidades terapéuticas en esta patología vascular, que mantiene a pesar de todo, una alta morbimortalidad.
Actualmente se realizan numerosas investigaciones para establecer con mayor precisión el diagnóstico y lograr aplicar los métodos de tratamiento más adecuados. A continuación se presentan siete casos clínicos con sus respectivas imágenes, tratamiento quirúrgico y evolución postoperatoria. Se hace una revisión concisa de la epidemiología, diagnóstico y tratamiento de los aneurismas gigantes con el objetivo de establecer el abordaje de esta patología.
Epidemiología
Los aneurismas gigantes constituyen lesiones de importancia clínica y de gran dificultad terapéutica. En promedio, representan el 5% de todos los aneurismas intracraneales según las diferentes series, se manifiestan usualmente en la cuarta - quinta década de la vida, y existe una predominancia por las mujeres en un 60 contra 40%.
Un 15% de los aneurismas gigantes intracraneales se asocian con otros aneurismas o malformaciones arteriovenosas intracraneales y en algunos casos se reportan aneurismas "en espejo".
Definición anatómica
Se definen clásicamente por el tamaño, cuyo diámetro debe ser igual o mayor a 2.5 cm. Sin embargo, en la actualidad existen 5 criterios que se deben de considerar para clasificar dichos aneurismas, estos son: la distribución topográfica, la forma, el diámetro del cuello, el lumen y la integridad de la pared. En términos generales los aneurismas de la circulación posterior, de cuello largo, fusiformes que están parcialmente trombosados y cuya arteria nutriente forma parte de la pared aneurismática representan los de mayor complejidad terapéutica y morbilidad - mortalidad.
Etiopatogenia
Mecanismos de formación:
Aspectos anatomopatológicos
La gran mayoría de los aneurismas gigantes son seculares, a nivel de las bifurcaciones de las arterias del polígono de Willis o sus ramas principales. Pueden ser únicos o múltiples de cuello usualmente ancho de 5 a 10 milímetros; se asocian con frecuencia a polígonos de Willis ateromatosos, sobre todo a nivel del cuello aneurismático. Se ha tratado de determinar la herencia del defecto que permite la formación de estas lesiones en la pared de los vasos sanguíneos cerebrales; se han observado con frecuencia en los síndromes angiodisplásicos y en enfermedades como Ehlers Danlos, Marfan y otras enfermedades que se caracterizan por alteraciones en los tejidos conectivos.
Y más que aneurismas gigantes estos pacientes padecen de dilataciones concéntricas del tronco arterial que han sido llamadas también megadólico arterias. Existen varias hipótesis sobre el mecanismo de formación, se ha establecido que existe un debilitamiento de la pared arterias y formación de una yema aneurismática la cual continúa dilatándose hasta llegar a formar el aneurisma gigante. Son entonces el crecimiento progresivo de pequeños aneurismas situados en las arterias cerebrales, principalmente a nivel de las bifurcaciones donde la hipertensión arterial, la ateroesclerosis y el estrés hemodinámico ejercen su efecto causal sobre un defecto de la media del vaso arterial. Después de esta primera fase sigue la de expansión progresiva por el fenómeno hemodinámico de la turbulencia o flujo caótico intraneurismático. Las fuerzas hemodinámicas tienen que vencer una fase crítica de debilitamiento que algunos autores establecen entre los 5 y 7 milímetros de diámetro, una vez superado éste el crecimiento aneurismático se da en forma contínua en unos casos más rápido. Inducido no sólo por la turbulencia del flujo sanguíneo sino también por la formación del trombo intraluminal, cambios inflamatorios, neoformación tisular y vascular que disecan las paredes del aneurisma dando paso a su crecimiento y adelgazamiento de la pared (9, 15, 20) .
El estudio reológico o comportamiento del flujo sanguíneo permite comprobar que en las arterias de mayor flujo y en las bifurcaciones de ángulo recto existe mayor estrés hemodinámico sobre la pared de ese vaso y por ende mayor riesgo en la formación de un aneurisma gigante.
Aspectos hemodinámicos
En un cilindro de un determinado diámetro el comportamiento de un fluído está regulado por la ley de Hagen-Poiseuille, el cual establece que las partículas se desplazan ordenadamente en forma de láminas rectilíneas paralelas al eje del tubo y que además establece que la velocidad de desplazamiento depende de las viscosidad del fluído de tal manera que, el flujo es más lento en las paredes del cilindro y más rápido hacia el centro del mismo.
El flujo en un vaso es laminar siempre y cuando éste sea recto; cuando existen cambios bruscos en la dirección del vector que lleva el trayecto de la circulación en ese sitio, el desplazamiento brusco de estas partículas genera un fenómeno conocido como flujo turbulento o turbulencia. La turbulencia está directamente relacionada con el grado de bifurcación o desviación en la dirección de tal manera, que a mayor desviación ésta es mayor. Las vibraciones y la turbulencia fatigan y debilitan la estructura elástica de la pared arterial anormal generando la lesión preaneurismática, siendo un fenómeno que se perpetúa. Partiendo de una nueva fase, el aneurisma representa un esfera, que empieza a crecer por los mecanismos descritos anteriormente, regidos por otra ley, la de Laplace. Esta dice, que para una esfera la tensión es proporcional al radio de la esfera donde:
T = PR/e T = tensión libre en la pared
2 P = presión
R = radio
e = es el espesor de la pared del saco aneurismático.
Se puede establecer que a mayor radio y menor espesor de la pared, la tensión será la responsable de la ruptura del aneurisma; un punto donde se rompe el equilibrio entre la tensión hemodinámica y las fuerzas opuestas de la pared del saco. Se ha descrito, según los análisis anatomopatológicos, que el espesor de la pared crítico para la ruptura es de 1 mm o menor. Muchos autores han tratado de establecer cuales aneurismas no rotos aún, se romperán y en que momento. Para esto idearon una formula basada en hechos experimentales, la cual relaciona la profundidad del aneurisma (P) (distancia lineal del cuello al domo del aneurisma) entre el ancho del cuello (A), generando un índice de medición objetivo P / A, si es mayor 1.6 existe un alto riesgo de ruptura por el sitio más débil de mismo que no necesariamente es el domo, como se ha pensado siempre (8). Sin embargo otros estudios demuestran en los vasos de mayor calibre, donde la velocidad del flujo sanguíneo es muy alta y existen aneurismas de cuello ancho, una mayor turbulencia intraaneurimática que como sea demostrado tiene un papel determinante en el crecimiento de cualquier aneurisma no sólo en los gigantes (ver Fig. 1 ). Una mayoría considerable de éstas lesiones no llegan a ser gigantes, ya que muchos de ellos se rompen en la fase crítica de expansión cuando llegan a los 5mm o los superan levemente (8). No se ha podido demostrar una relación significativa entre la edad de los pacientes, tamaño del aneurisma al momento del diagnóstico y el intervalo de tiempo entre el diagnóstico y la ruptura.
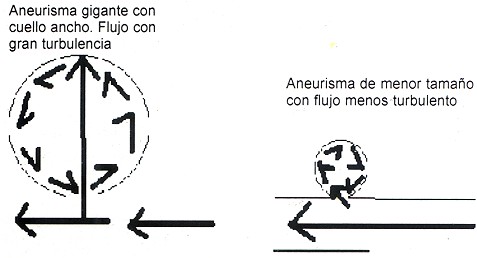
Múltiples factores son determinantes en la génesis y desarrollo de los diferentes tipos y tamaños de aneurismas, pero tienen en común el potencial riesgo de sangrado en mayor o menor grado; por tanto cada lesión debe individualizarse con el objetivo de establecer cuándo hacer y qué hacer con ellos. En la actualidad todo aneurisma aunque sea pequeño debe ser tratado de forma definitiva una vez diagnosticado (9, 10, 11).Fig. 1 Modelo ideal de comparación del flujo sanguíneo, según el ancho del cuello y la profundidad del aneurisma en el caso de no haber trombos intaluminales. En caso de estar parcialmente trombosado que es lo más frecuente, el flujo sanguíneo no es simétrico como se muestra.
TABLA 1
FRECUENCIA Y DISTRIBUCION ANATOMICA DE LOS ANEURISMAS GIGANTES EN
COMPARACION CON LA DISTRIBUCION DE TODOS LOS ANEURISMAS EN GENERAL (16).
FRECUENCIA Y DISTRIBUCION ANATOMICA DE LOS ANEURISMAS GIGANTES EN
COMPARACION CON LA DISTRIBUCION DE TODOS LOS ANEURISMAS EN GENERAL (16).
| Aneurisma en general |
Gigantes |
|
| Complejo anterior y comunicante ant. |
23% |
10% |
| Carótida interna |
40% |
29% |
| - bifurcación |
13% |
10% |
| -- suproclinoidea |
26% |
7% |
| --- carótido-oftálmico |
1% |
12% |
| Seno cavernoso |
2% |
13% |
| Cerebral media |
10% |
15% |
| Complejo posterior |
5% |
33% |
| Arteria Com. Posterior |
-15% |
|
| Arteria Cerebral Posterior |
-2% |
|
| Tronco Basilar |
-9% |
|
| PICA (posterior inferior cerebelosa arteria) |
-1% |
|
| Vertebral |
-6% |
En términos generales, los aneurismas del seno cavernoso se comportan como masas expansivas. Los aneurismas subaracnoideos sangran en un 40%, 4% se manifiestan por síndromes isquémicos, 40 a 80% como síndromes pseudotumorales. De las series de aneurismas diagnosticados no operados, el evento más común ha sido la hemorragia. Los síndromes pseudotumorales se pueden agrupar en tres áreas topográficas: a) segmento carótido-oftálmico, comunicante anterior, de carótida interna en relación con la comunicante posterior: compresión optoquiasmática y síndromes hipofiso-hipotalámicos. b) bifurcación de carótida y cerebral media: crisis convulsivas y síndromes compresivos basihemisféricos. c) fosa posterior: síndromes compresivos de pares craneales y vías largas según la localización de la masa aneurismática. (16).
Diagnóstico neuroradiológico
Estableciendo los aspectos más sobresalientes de cada uno de los métodos de diagnóstico neuroradiológico, todos son importantes y deben ser valorados en conjunto para el abordaje de cada caso en particular.
La radiografía simple de cráneo puede demostrar hallazgos indirectos como calcificación del saco aneurismático y erosiones óseas de la silla turca, apex orbitario, seno esfenoidal, de la fosa media entre otros, que sugieren un proceso crónico de presión sobre el hueso.
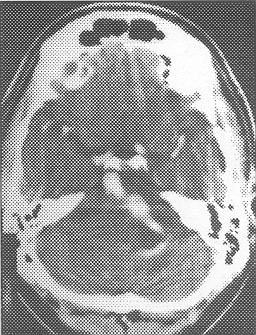
El TAC sin contraste establece en muchos caso el diagnóstico sindrómico de hemorragia subaracnoidea, hace sospechar el diagnostico de ruptura aneurismática, orienta hacia el sitio del mismo por la cuantía del sangrado en esa área específica y puede demostrar la masa parcial o totalmente trombosada (Fig. 2, 3, 4) El contraste refuerza la pared aneurismática por la neoformación vascular que tiene, inducida por cambios inflamatorios y de trombosis. El AngioTAC con cortes del Polígono de Willis, permite detectar: a) el aneurisma con un sensibilidad y especificidad de un 86% y un 90% respectivamente, es más rápido, poca invasión y de bajo costo; b) el tejido perianeurismático y signos de efecto de masa; no así otras características igual de importantes como la relación con el vaso nutriente, la dimensión del cuello, la situación tridimensional, cuantía del flujo arterial y circulación colateral ( Fig. 2) Las lesiones de menos de 3mm e inusualmente localizadas son difíciles de diagnosticar por este medio. (3, 12)
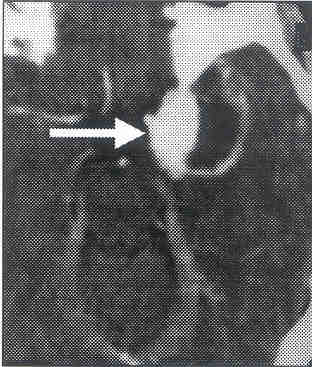
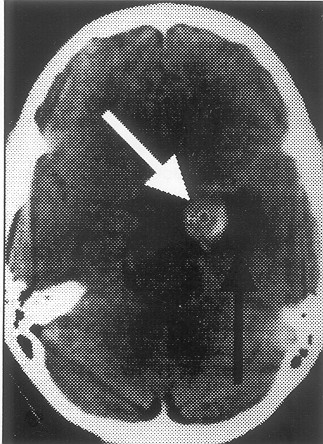
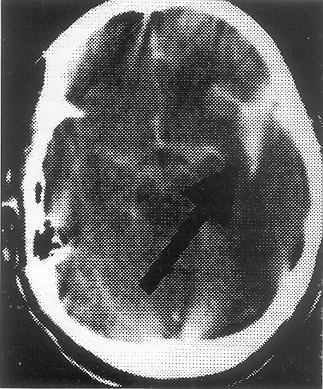
Fig. 3. TAC sin contraste, HSA, mayor cantidad de sangre a nivel cisterna silviana lzda.
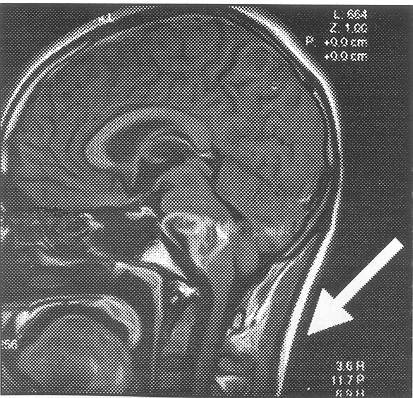
Fig. 6. Aneurisma gigante de la basilar, nótese el efecto de masa sobre el tronco cerebral y el grado de trombosis intraluminal.
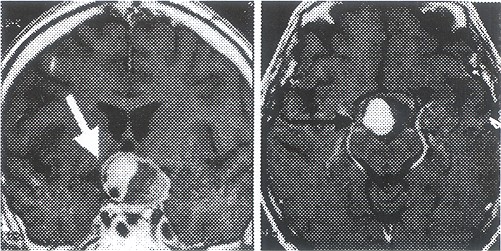
Fig. 7 lzda: Aneurisma supraclinoideo tombosado con efecto de masa a nivel diencéfalo hipofisiario. Desplaza el piso del tercer ventrículo comprimiendo estructuras optoquiasmáticas. Der: aneurisma de la arteria comunicante posterior derecha trombosado en TI.
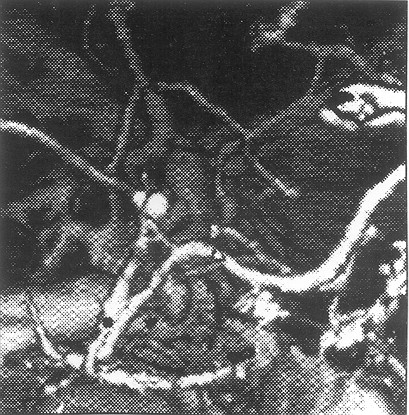
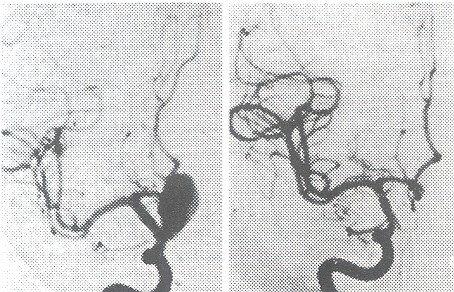
La angiografía convencional; existe dificultad para valorar las imágenes debido a una superposición de los huesos del cráneo y sus accidentes anatómicos. Fig. 10 y 11.
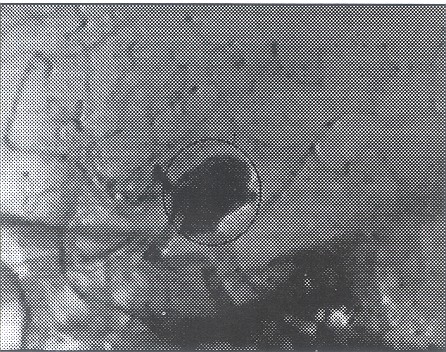
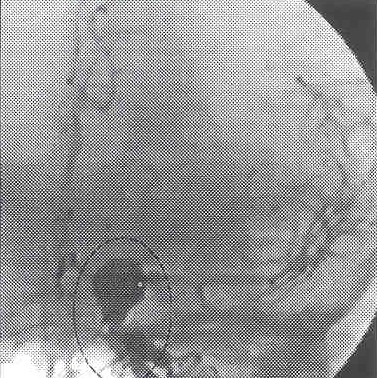
La ADS es el método diagnóstico por excelencia, realizada por manos expertas, tiene una sensibilidad del 99% y una especificidad del 100%. Las lesiones excluidas de la circulación arterial tales como los aneurismas trombosados, se diagnostican por otros medios como el ATAC helicoidal. Permite definir: a) la localización y tipo de aneurisma; b) forma y situación del cuello en la arteria nutriente; c) incorporación del vaso madre y/o sus ramas a las paredes del saco aneurismático; d) grado de trombosis, contornos del saco y volumen del aneurisma; e) es un estudio hemodinámico, que permite establecer el flujo intraaneurismático y de su vaso nutriente, el estado del resto de la circulación cerebral, el calibre de los vasos, permeabilidad de las comunicantes y su dominancia, calidad de la circulación externa en caso de requerir puentes extra-intracraneales. Dada la posibilidad de múltiples proyecciones se pueden estudiar los vasos desde varios ángulos disminuyendo la posibilidad de falsos diagnósticos.
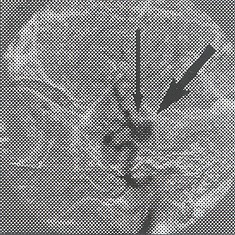
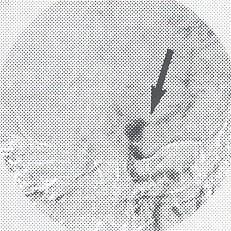
Descrito por Hosobuchi en 1985, la trombosis intraluminal inducida por filamentos metálicos introducidos por punción directa del saco aneurimático, para lesiones de difícil acceso por vía endovascular.
Oclusión del vaso proximal con o sin bypasss extracraneal-intracraneal
La oclusión arterial proximal mediante la ligadura hunteriana de arterias cerebrales que dan origen a los aneurismas gigantes, cuando es tolerado, es un método efectivo, logrando la trombosis y/o exclusión del aneurisma hasta en un 83% de las lesiones anteriores y posteriores. La asociación con bypass extra-intracraneal ha disminuido aún más los riesgos de isquemia, en aquellos casos en los cuales la circulación colateral es insuficiente.
Terapia endovascular
Imaginado por Brooks en 1930, que introdujo un fragmento de músculo en la carótida primitiva para embolizar una fístula carótidocavernosa. Straube y Dotter en 1963 introdujeron cateteres percutáneos hasta el sifón carotídeo. Desde 1964 Luessenhop y Velásquez iniciaron el tratamiento de estas lesiones en forma rutinaria con cateres percutáneos. El principal aporte que ha pemitido llegar hoy por hoy, la angiología invasiva, fueron los catéteres con balones desprendibles desarrollados por Serbinenko y Debrun.
El procedimiento ideal consiste en tratar en forma selectiva el aneurisma y el tratamiento paliativo en sacrificar el flujo arterial del vaso nutriente, todos estos procedimientos son con ADS y TAC postcirugía para descartar embolización. Los materiales más utilizados son los balones desprendibles de latex y los coils o filamentos introducidos por Guglielmi de platinum o cobre. En el primer caso, los aneurismas deben de tener un cuello cuyo diámetro, sea igual o mayor al del balón. En la actualidad se aceptan para tratamiento endovascular aquellos con diámetros entre 5 y 10 mm, para minimizar las complicaciones por migración del balón o ruptura por sobredistención. Desventajas, el aneurisma debe tomar la forma del balón, condición que puede predisponer a un empeoramiento del síndrome pseudotumoral, desprendimiento de los trombos intraluminales y embolismo distal; lesiones isquémicas por circulación colateral insuficiente.
La electrotombosis del aneurisma puede ser por electrofialmentos 0 coils intraaneurismáticos, recientemente Guglielmi introdujo los coils de platinum, que se adaptan a la forma de la lesión, para evitar la ruptura del mismo. La cirugía endocascular es un procedimiento que en manos expertas es efectivo entre un 70 a un 100%. Dentro de las complicaciones está la migración del filamento a territorio no deseado.
La oclusión del vaso proximal con balón, puede ser temporal y en el mismo acto quirúrgico, evaluar el estado de la circulación colateral. Decidir cuales son tributarios a bypass y cuales no. Desventajas, trombosis incompleta, recanalización del aneurisma, ruptura aneurismática, embolismo a distancia.
La cirugía endovascular, representa una método alternativo en desarrollo, para el tratamiento de los aneurismas gigantes, que en principio deben ser estudiados y ser sujeto de discusión su posibilidad quirúrgica de forma directa.
Tratamiento de acuerdo a la localización den aneurisma gigante
Carótido-oftálmico.
Con el desarrollo de la cirugía de base de cráneo, son relativamente accesibles al abordaje directo, el campo operatorio es más amplio con la resección de la clinoides anterior y el destechamiento de la orbita. En segundo lugar puede realizarse un atrapamiento vascular por debajo de la comunicante posterior y ligadura de la carótida en cuello, con o sin bypass dependiendo de la circulación colateral.
Carótido-cavernoso.
La tendencia actual es la oclusión del aneurisma por vía endovascular con balón desprendible, con o sin bypass según la irrigación distal al segmento a excluir. Anteriormente se prefería el atrapamiento vascular por cirugía directa.
Carótido-comunicante Posterior -bifurcación.
Abordaje directo por clipaje del cuello aneurismático.
Arteria cerebral media, Complejo anterior y cerebral posterior.
Abordaje del cuello y clipaje del mismo. Mucho autores sugieren en estos aneurismas la microdisección con coagulación bipolar baja del cuello, para permitir su oclusión directa por el clip. Sin embargo debido a la existencia de múltiples formas y tamaños de clips, esta técnica ya casi no es necesaria. En otros casos, el atrapamiento vascular con reconstrucción arterial y/o bypass es preferible.

Discusión
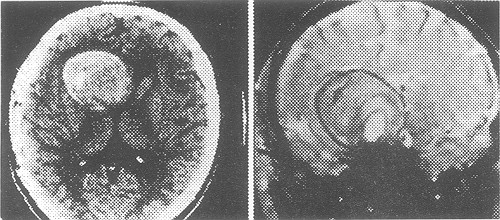
A diferencia de la literatura donde se reporta una predominancia en mujeres, en este pequeño estudio predominaron los hombres por 1 caso. La edad de presentación, estuvo en promedio en la cuarta década de la vida como es esperado. Hubo cuatro casos de aneurismas de carótida, uno de cerebral media y dos del sistema vertebro-basilar. Los del sistema verte-brobasilar fueron fusiformes, comprometían casi todo el tronco de la basilar, estaban parcialmente trombosados ambos y se manifestaron con un síndrome compresivo de pares craneales a nivel del tronco cerebral, hechos comparables con la literatura mundial.
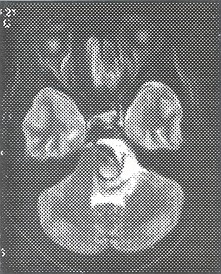
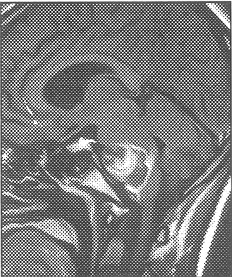
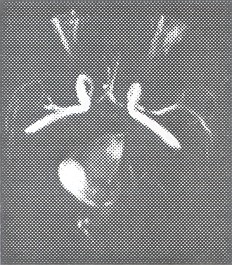
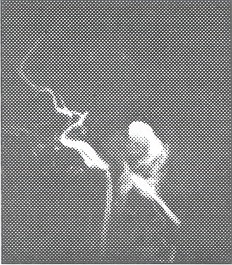
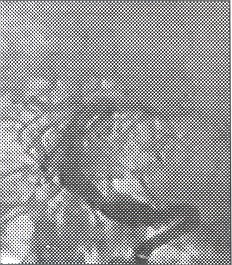
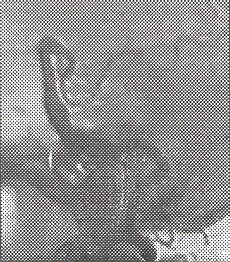
Fig. 22 y 23. Arteriografía convencional, megadólico arteria a nivel de la Basilar, dilatación anormal, tortuosa desde su inicio.
La
IRM y la ARMN, son muy útiles en el diagnóstico, sobre
todo en aquellos casos en los cuales los procedimientos con medios de
contraste yodados y /o invasivos implican un alto riesgo médico
y quirúrgico. Los estimados actuales de sensibilidad de
estos métodos oscila en un 60 y 90 %, esto puede mejorar con el
uso de gadolinium (12). Permiten descartar otros
diagnósticos diferenciales vasculares o cerebrales e incluso clasificar
los aneurismas en no trombosados, parcialmente trombosados o trombosados
en su totalidad, según las características intraaneurismáticas.
Sin embargo, la ausencia de “vacío” en la IRM o de señal hiperintensa
en la ARMN, impide diagnosticar el aneurisma, clasificarlo correctamente
como trombosado o confundirlo con un tumor pequeño (12).
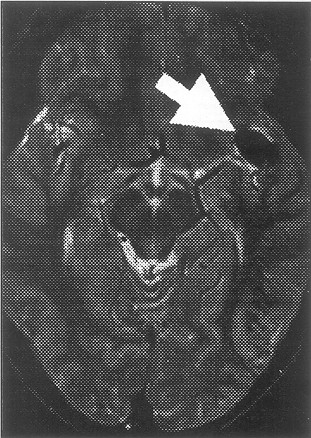
Fig. 5. Señal de “vacío” vascular (flow void)
en T2, en un paciente con un aneurisma silviano izquierdo.

Fig. 6. Aneurisma gigante de la basilar, nótese el efecto de masa sobre el tronco cerebral y el grado de trombosis intraluminal.
Estas
señales dependen de la velocidad del flujo cerebral y no se producen
cuando no tienen suficiente velocidad. En los aneurismas menos
de 1 cm, el efecto de vacío estuvo presente sólo en el 53
% de los casos. De manera que estos métodos no han alcanzado
la contabilidad para descartar la presencia de un aneurisma intracraneal
( Fig. 5).

Fig. 7 lzda: Aneurisma supraclinoideo tombosado con efecto de masa a nivel diencéfalo hipofisiario. Desplaza el piso del tercer ventrículo comprimiendo estructuras optoquiasmáticas. Der: aneurisma de la arteria comunicante posterior derecha trombosado en TI.
El
AngioTAC helicoidal tiene una sensibilidad del 97,3% y una especificidad
del 100% comparada con la ADS. Es un método no invasivo,
rápido y muy confiable, no está limitado por la existencia
de clips metálicos de cirugías previas y permite diagnosticar
el vasoespasmo, da imágenes tridimensionales. Realmente
representa la alternativa más cerca a la ADS (21).
Fig. 8 y 9. Imagen normal y ampliada de
un aneurisma carótida - CoP.

La angiografía convencional; existe dificultad para valorar las imágenes debido a una superposición de los huesos del cráneo y sus accidentes anatómicos. Fig. 10 y 11.


La ADS es el método diagnóstico por excelencia, realizada por manos expertas, tiene una sensibilidad del 99% y una especificidad del 100%. Las lesiones excluidas de la circulación arterial tales como los aneurismas trombosados, se diagnostican por otros medios como el ATAC helicoidal. Permite definir: a) la localización y tipo de aneurisma; b) forma y situación del cuello en la arteria nutriente; c) incorporación del vaso madre y/o sus ramas a las paredes del saco aneurismático; d) grado de trombosis, contornos del saco y volumen del aneurisma; e) es un estudio hemodinámico, que permite establecer el flujo intraaneurismático y de su vaso nutriente, el estado del resto de la circulación cerebral, el calibre de los vasos, permeabilidad de las comunicantes y su dominancia, calidad de la circulación externa en caso de requerir puentes extra-intracraneales. Dada la posibilidad de múltiples proyecciones se pueden estudiar los vasos desde varios ángulos disminuyendo la posibilidad de falsos diagnósticos.


Podemos
establecer que ningún método es excluyente de otro, todos
valorados en conjunto permitirán planear el método quirúrgico
más viable para conseguir el objetivo de oro, la exclusión
del aneurisma de la circulación. Para ello, existen múltiples
técnicas quirúrgicas tanto directas como indirectas que citaremos
seguidamente.
Tratamiento
Historia
En 1885, Sir Victor Horsley, ligó las carótidas internas en un paciente con un aneurisma gigante de la arteria comunicante anterior. Harvey Cushing en 1911 inventó el clip de plata e hizo el primer recubrimiento con músculo en 1929. Norman Dott, en 1931 realiza su primer clipaje directo de un aneurisma. Dandy es el primero en ligar un aneurisma y en 1944 describe 108 pacientes de los cuales operó 30 directamente. Drake en 1975 publica la primera serie de casos con oclusión del sistema vertebro basilar por el método del torniquete. Sundt y Piepgrass en 1979 realizan el bypass Carótida Externa-Carótida Interna con ligadura de la carótida interna. Sugita en 1980 introduce sus clips fenestrados. Serbinenko y Debrun realizan la primera oclusión vascular con balones desprendibles. Yasargil desde 1980 desarrolla sus clips según el tipo de cuello del aneurisma largos o extra largos. Silverberg en 1981 usa hipotermia y arresto cardíaco en el tratamiento de estos aneurismas. En 1988 Hilal realiza trombosis intraaneurismática con filamentos de platinum por abordaje directo. Guglielmi en 1991 introduce la electrotrombosis de aneurismas seculares vía endovascular.
Todos los citados anteriormente, han tenido un objetivo, que sigue hoy por hoy siendo la regla de oro; el mejor tratamiento para un aneurisma intracraneal es el abordaje directo del mismo, mediante el clipaje de su cuello y la preservación de su vaso nutriente y sus ramas, excluyéndolo completamente de la circulación arterias. De gran importancia son el tipo de clip empleado y la disección para la preparación del cuello.
Tratamiento quirúrgico
Abordaje directo del cuello aneurismático y ciplinaje del mismo
La forma más confiable de establecer la posibilidad de clipar el cuello, es la exploración directa de la lesión (16). Una cuidadosa disección para la preparación del cuello y la escogencia del tipo de clip según las características del cuello, si es muy ancho, si está o no incluido el vaso nutriente o estructuras nerviosas peri aneurismáticas. Un único clip no es suficiente, por lo general dos o más son necesarios. Drake usa el clipaje en "tandem" con clips fenestrados. Otros autores como Sugita realiza clipajes en oposición. Y recomiendan clipar unos milímetros a distancia alejado de la implantación del cuello en el vaso nutriente, para evitar ocluir éste al cerrar el clip o desprender del todo el aneurisma de la arteria principal. Otras complicaciones igual de graves son: el desprendimiento de placas de ateroma, embolización a partir de los trombos intraluminales, oclusión parcial del cuello y persistencia del flujo aneurismático. En los aneurismas parcialmente trombosados se debe realizar un clipaje temporal de la arteria madre, remover el coagulo, disminuir el tamaño de la lesión por coagulación bipolar si es posible, para porteriormente colocar el clip definitivo en el cuello del mismo. En los aneurismas totalmente trombosados, la trombectomía parcial, seguida del clipaje temporal y en lo posible la aneurismectomía con reparación del vaso o parcial con clipaje del cuello, permitirán eliminar o reducir el efecto de masa que producen estas lesiones gigantes. Elementos como cuellos muy largos, paredes gruesas, fragilidad de la base de implantación, nacimiento de colaterales disminuyen de forma importante la posibilidad de clipaje.
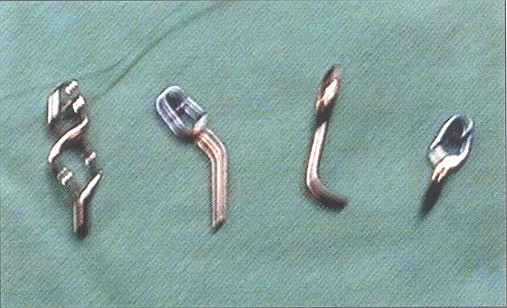
Abordaje directo para la disminución del volumen de la masa aneurismática
Implica por lo general clipaje temporal del vaso madre, trombectomía total o parcial con clipaje del cuello o aneurismectomía y reparación del vaso madre. Ideal para lesiones que no contienen en su pared al vaso madre o ramas arteriales que nazcan de él y que el tejido vascular permita suturarlo.
Aneurismectomía con aspiración intraluminal del contenido hemático, coagulación bipolar del saco aneurismático y clipaje del cuello. (16)
Exclusión indirecta por abordaje directo
Consiste en la exploración intracraneal del aneurisma y su exclusión arterias por atrapamiento vascular o por trombosis intraluminal . El atrapamiento vascular se puede realizar en vasos madre sin otras ramas arteriales y cuyo aporte vascular al cerebro sea adecuadamente suplido por circulación colateral. Posible en aneurismas de carótida interna intracavernosa, segmento carótido-oftálmico y arterias vertebrales.
Tratamiento
Historia
En 1885, Sir Victor Horsley, ligó las carótidas internas en un paciente con un aneurisma gigante de la arteria comunicante anterior. Harvey Cushing en 1911 inventó el clip de plata e hizo el primer recubrimiento con músculo en 1929. Norman Dott, en 1931 realiza su primer clipaje directo de un aneurisma. Dandy es el primero en ligar un aneurisma y en 1944 describe 108 pacientes de los cuales operó 30 directamente. Drake en 1975 publica la primera serie de casos con oclusión del sistema vertebro basilar por el método del torniquete. Sundt y Piepgrass en 1979 realizan el bypass Carótida Externa-Carótida Interna con ligadura de la carótida interna. Sugita en 1980 introduce sus clips fenestrados. Serbinenko y Debrun realizan la primera oclusión vascular con balones desprendibles. Yasargil desde 1980 desarrolla sus clips según el tipo de cuello del aneurisma largos o extra largos. Silverberg en 1981 usa hipotermia y arresto cardíaco en el tratamiento de estos aneurismas. En 1988 Hilal realiza trombosis intraaneurismática con filamentos de platinum por abordaje directo. Guglielmi en 1991 introduce la electrotrombosis de aneurismas seculares vía endovascular.
Todos los citados anteriormente, han tenido un objetivo, que sigue hoy por hoy siendo la regla de oro; el mejor tratamiento para un aneurisma intracraneal es el abordaje directo del mismo, mediante el clipaje de su cuello y la preservación de su vaso nutriente y sus ramas, excluyéndolo completamente de la circulación arterias. De gran importancia son el tipo de clip empleado y la disección para la preparación del cuello.
Tratamiento quirúrgico
Abordaje directo del cuello aneurismático y ciplinaje del mismo
La forma más confiable de establecer la posibilidad de clipar el cuello, es la exploración directa de la lesión (16). Una cuidadosa disección para la preparación del cuello y la escogencia del tipo de clip según las características del cuello, si es muy ancho, si está o no incluido el vaso nutriente o estructuras nerviosas peri aneurismáticas. Un único clip no es suficiente, por lo general dos o más son necesarios. Drake usa el clipaje en "tandem" con clips fenestrados. Otros autores como Sugita realiza clipajes en oposición. Y recomiendan clipar unos milímetros a distancia alejado de la implantación del cuello en el vaso nutriente, para evitar ocluir éste al cerrar el clip o desprender del todo el aneurisma de la arteria principal. Otras complicaciones igual de graves son: el desprendimiento de placas de ateroma, embolización a partir de los trombos intraluminales, oclusión parcial del cuello y persistencia del flujo aneurismático. En los aneurismas parcialmente trombosados se debe realizar un clipaje temporal de la arteria madre, remover el coagulo, disminuir el tamaño de la lesión por coagulación bipolar si es posible, para porteriormente colocar el clip definitivo en el cuello del mismo. En los aneurismas totalmente trombosados, la trombectomía parcial, seguida del clipaje temporal y en lo posible la aneurismectomía con reparación del vaso o parcial con clipaje del cuello, permitirán eliminar o reducir el efecto de masa que producen estas lesiones gigantes. Elementos como cuellos muy largos, paredes gruesas, fragilidad de la base de implantación, nacimiento de colaterales disminuyen de forma importante la posibilidad de clipaje.

Abordaje directo para la disminución del volumen de la masa aneurismática
Implica por lo general clipaje temporal del vaso madre, trombectomía total o parcial con clipaje del cuello o aneurismectomía y reparación del vaso madre. Ideal para lesiones que no contienen en su pared al vaso madre o ramas arteriales que nazcan de él y que el tejido vascular permita suturarlo.
Aneurismectomía con aspiración intraluminal del contenido hemático, coagulación bipolar del saco aneurismático y clipaje del cuello. (16)
Exclusión indirecta por abordaje directo
Consiste en la exploración intracraneal del aneurisma y su exclusión arterias por atrapamiento vascular o por trombosis intraluminal . El atrapamiento vascular se puede realizar en vasos madre sin otras ramas arteriales y cuyo aporte vascular al cerebro sea adecuadamente suplido por circulación colateral. Posible en aneurismas de carótida interna intracavernosa, segmento carótido-oftálmico y arterias vertebrales.
Descrito por Hosobuchi en 1985, la trombosis intraluminal inducida por filamentos metálicos introducidos por punción directa del saco aneurimático, para lesiones de difícil acceso por vía endovascular.
Oclusión del vaso proximal con o sin bypasss extracraneal-intracraneal
La oclusión arterial proximal mediante la ligadura hunteriana de arterias cerebrales que dan origen a los aneurismas gigantes, cuando es tolerado, es un método efectivo, logrando la trombosis y/o exclusión del aneurisma hasta en un 83% de las lesiones anteriores y posteriores. La asociación con bypass extra-intracraneal ha disminuido aún más los riesgos de isquemia, en aquellos casos en los cuales la circulación colateral es insuficiente.
Terapia endovascular
Imaginado por Brooks en 1930, que introdujo un fragmento de músculo en la carótida primitiva para embolizar una fístula carótidocavernosa. Straube y Dotter en 1963 introdujeron cateteres percutáneos hasta el sifón carotídeo. Desde 1964 Luessenhop y Velásquez iniciaron el tratamiento de estas lesiones en forma rutinaria con cateres percutáneos. El principal aporte que ha pemitido llegar hoy por hoy, la angiología invasiva, fueron los catéteres con balones desprendibles desarrollados por Serbinenko y Debrun.
El procedimiento ideal consiste en tratar en forma selectiva el aneurisma y el tratamiento paliativo en sacrificar el flujo arterial del vaso nutriente, todos estos procedimientos son con ADS y TAC postcirugía para descartar embolización. Los materiales más utilizados son los balones desprendibles de latex y los coils o filamentos introducidos por Guglielmi de platinum o cobre. En el primer caso, los aneurismas deben de tener un cuello cuyo diámetro, sea igual o mayor al del balón. En la actualidad se aceptan para tratamiento endovascular aquellos con diámetros entre 5 y 10 mm, para minimizar las complicaciones por migración del balón o ruptura por sobredistención. Desventajas, el aneurisma debe tomar la forma del balón, condición que puede predisponer a un empeoramiento del síndrome pseudotumoral, desprendimiento de los trombos intraluminales y embolismo distal; lesiones isquémicas por circulación colateral insuficiente.
La electrotombosis del aneurisma puede ser por electrofialmentos 0 coils intraaneurismáticos, recientemente Guglielmi introdujo los coils de platinum, que se adaptan a la forma de la lesión, para evitar la ruptura del mismo. La cirugía endocascular es un procedimiento que en manos expertas es efectivo entre un 70 a un 100%. Dentro de las complicaciones está la migración del filamento a territorio no deseado.
La oclusión del vaso proximal con balón, puede ser temporal y en el mismo acto quirúrgico, evaluar el estado de la circulación colateral. Decidir cuales son tributarios a bypass y cuales no. Desventajas, trombosis incompleta, recanalización del aneurisma, ruptura aneurismática, embolismo a distancia.
La cirugía endovascular, representa una método alternativo en desarrollo, para el tratamiento de los aneurismas gigantes, que en principio deben ser estudiados y ser sujeto de discusión su posibilidad quirúrgica de forma directa.
Tratamiento de acuerdo a la localización den aneurisma gigante
Carótido-oftálmico.
Con el desarrollo de la cirugía de base de cráneo, son relativamente accesibles al abordaje directo, el campo operatorio es más amplio con la resección de la clinoides anterior y el destechamiento de la orbita. En segundo lugar puede realizarse un atrapamiento vascular por debajo de la comunicante posterior y ligadura de la carótida en cuello, con o sin bypass dependiendo de la circulación colateral.
Carótido-cavernoso.
La tendencia actual es la oclusión del aneurisma por vía endovascular con balón desprendible, con o sin bypass según la irrigación distal al segmento a excluir. Anteriormente se prefería el atrapamiento vascular por cirugía directa.
Carótido-comunicante Posterior -bifurcación.
Abordaje directo por clipaje del cuello aneurismático.
Arteria cerebral media, Complejo anterior y cerebral posterior.
Abordaje del cuello y clipaje del mismo. Mucho autores sugieren en estos aneurismas la microdisección con coagulación bipolar baja del cuello, para permitir su oclusión directa por el clip. Sin embargo debido a la existencia de múltiples formas y tamaños de clips, esta técnica ya casi no es necesaria. En otros casos, el atrapamiento vascular con reconstrucción arterial y/o bypass es preferible.

Fig. 14. Aneurisma gigante del complejo anterior
parcialmente trombosado TAC y IRMT2
Complejo vertebro-basilar.
Son los más difíciles y peligrosos. Su abordaje directo y exclusión por clipaje de su cuello es lo ideal. Sin embargo en las series, el procedimiento realizado con mayor frecuencia es la oclusión del vaso madre por vía endovascular, sobre todo a nivel vertebral, unión vertebro-basilar, tronco basilar, requiere de una comunicante posterior que supla de forma adecuada el flujo a nivel de la basilar superior. A nivel de la arteria cerebelosa superoanterior y tip de la basilar, la relación es parecida en cuanto a clipaje y oclusion proximal. El pronóstico de los aneurismas gigantes de la bifurcación de la basilar es reservado por cuanto es difícil preservar la ramas perforantes que usualmente nacen del domo del aneurisma.
Angiografía de control postcirugía
Es una indicación racional para el control postclipaje trans o postoperatoria, los aneurismas con cuello residual tienden por lo general a permanecer estables, sin embargo una pequeña cantidad pueden presentar neoformaciones aneurismáticas. El riesgo es muy bajo, pero según algunos estudios es significativo estadísticamente. Otros autores como Yasargil no usa arteriografía transoperatoria, ya que le cirujano debe estar seguro de donde colocó el clip .
Materiales y métodos
Un total de 15 pacientes se presentaron al servicio de emergencias entre enero y noviembre de 1999. 14 de ellos con sintomatología de hemorragia subaracnoidea o déficit neurológico y 1 caso por trauma encéfalocraneal al que se le diagnosticó un aneurisma de forma incidental. A 7 de los 15 casos se les diagnosticó al menos un aneurisma gigante. Se presenta el análisis de los mismo, su abordaje diagnóstico y terapéutico, evolución clínica y una discusión sobre la patología en la actualidad.
Resultados
Un total de siete pacientes portadores de un aneurisma gigante intracraneal, han sido tratados en el servicio de neurocirugía, de un total de 15 aneurismas en 1999. Con edades entre 13 y 65 años, para un promedio de 35 años. Hubo predominio en los hombres (4 a 3). En 5 casos, la sintomatología principal fue un hemorragia subaracnoidea, 2 de ellos sin déficit neurológico y 3 con compromiso del estado de conciencia, pares craneales y hemiplejia contralateral Un caso se diagnosticó en una tomografía axial computarizada (TAC) en una valoración control postrauma encefalocraneal y el paciente restante tuvo compromiso principalmente de pares craneales bajos Y trastornos de conciencia. El efecto de masa estuvo presente, en los casos con compromiso de los pares bajos y vías largas a nivel de tronco cerebral. Todos los pacientes se les realizó una tomodensitometría axial sin y con contraste, encontrándose en 5 casos la hemorragia subaracnoidea e imagen compatible con aneurisma parcialmente trombosado en los 7 casos. En 2 casos había leve ventriculomegalia que no requirió derivación de L.C.R.. 2 estudios de IRM, un de ellos falleció antes de poder realizarle la arteriografía y en 6 casos, fue posible confirmar el diagnóstico por angiografía convencional en 3 casos y ADS en otros 3.
Los estudios angiográficos evidenciaron, 4 aneurismas gigantes de la arteria carótida interna izquierda, 1 de la porción supraclinoidea, 1 de la bifurcación y 2 en relación con la arteria comunicante posterior; el paciente con el aneurisma de la bifurcación de la carótida izquierda tenía, otro aneurisma de l cm en la carótida interna derecha en relación con la comunicante, creemos que el del sangrado fue el aneurisma pequeño por los hallazgos en el TAC a nivel, de la cisterna perimesencefálica y silviana derecha. 1 aneurisma gigante de la cerebral media izquierda, 2 casos con compromiso de la arteria basilar. De los 7 casos, no fueron considerados quirúrgicos los 2 aneurismas de la basilar, 4 han sido operados, 2 con éxito, 1 con déficit postquirúrgico y 1 caso de 13, fallecido por isquemia y edema distal al aneurisma de la trifurcación de la cerebral media. El último caso Hunt y Hess 3-4, no se ha podido operar hasta el momento. Los aneurismas fueron excluidos de la circulación mediante clipaje directo de su cuello, en los 2 casos de aneurismas de carótida en relación con la arteria comunicante posterior (CoP) se utilizó un único clip fenestrado de titanio en cada caso.
Son los más difíciles y peligrosos. Su abordaje directo y exclusión por clipaje de su cuello es lo ideal. Sin embargo en las series, el procedimiento realizado con mayor frecuencia es la oclusión del vaso madre por vía endovascular, sobre todo a nivel vertebral, unión vertebro-basilar, tronco basilar, requiere de una comunicante posterior que supla de forma adecuada el flujo a nivel de la basilar superior. A nivel de la arteria cerebelosa superoanterior y tip de la basilar, la relación es parecida en cuanto a clipaje y oclusion proximal. El pronóstico de los aneurismas gigantes de la bifurcación de la basilar es reservado por cuanto es difícil preservar la ramas perforantes que usualmente nacen del domo del aneurisma.

Angiografía de control postcirugía
Es una indicación racional para el control postclipaje trans o postoperatoria, los aneurismas con cuello residual tienden por lo general a permanecer estables, sin embargo una pequeña cantidad pueden presentar neoformaciones aneurismáticas. El riesgo es muy bajo, pero según algunos estudios es significativo estadísticamente. Otros autores como Yasargil no usa arteriografía transoperatoria, ya que le cirujano debe estar seguro de donde colocó el clip .
Materiales y métodos
Un total de 15 pacientes se presentaron al servicio de emergencias entre enero y noviembre de 1999. 14 de ellos con sintomatología de hemorragia subaracnoidea o déficit neurológico y 1 caso por trauma encéfalocraneal al que se le diagnosticó un aneurisma de forma incidental. A 7 de los 15 casos se les diagnosticó al menos un aneurisma gigante. Se presenta el análisis de los mismo, su abordaje diagnóstico y terapéutico, evolución clínica y una discusión sobre la patología en la actualidad.
Resultados
Un total de siete pacientes portadores de un aneurisma gigante intracraneal, han sido tratados en el servicio de neurocirugía, de un total de 15 aneurismas en 1999. Con edades entre 13 y 65 años, para un promedio de 35 años. Hubo predominio en los hombres (4 a 3). En 5 casos, la sintomatología principal fue un hemorragia subaracnoidea, 2 de ellos sin déficit neurológico y 3 con compromiso del estado de conciencia, pares craneales y hemiplejia contralateral Un caso se diagnosticó en una tomografía axial computarizada (TAC) en una valoración control postrauma encefalocraneal y el paciente restante tuvo compromiso principalmente de pares craneales bajos Y trastornos de conciencia. El efecto de masa estuvo presente, en los casos con compromiso de los pares bajos y vías largas a nivel de tronco cerebral. Todos los pacientes se les realizó una tomodensitometría axial sin y con contraste, encontrándose en 5 casos la hemorragia subaracnoidea e imagen compatible con aneurisma parcialmente trombosado en los 7 casos. En 2 casos había leve ventriculomegalia que no requirió derivación de L.C.R.. 2 estudios de IRM, un de ellos falleció antes de poder realizarle la arteriografía y en 6 casos, fue posible confirmar el diagnóstico por angiografía convencional en 3 casos y ADS en otros 3.
Los estudios angiográficos evidenciaron, 4 aneurismas gigantes de la arteria carótida interna izquierda, 1 de la porción supraclinoidea, 1 de la bifurcación y 2 en relación con la arteria comunicante posterior; el paciente con el aneurisma de la bifurcación de la carótida izquierda tenía, otro aneurisma de l cm en la carótida interna derecha en relación con la comunicante, creemos que el del sangrado fue el aneurisma pequeño por los hallazgos en el TAC a nivel, de la cisterna perimesencefálica y silviana derecha. 1 aneurisma gigante de la cerebral media izquierda, 2 casos con compromiso de la arteria basilar. De los 7 casos, no fueron considerados quirúrgicos los 2 aneurismas de la basilar, 4 han sido operados, 2 con éxito, 1 con déficit postquirúrgico y 1 caso de 13, fallecido por isquemia y edema distal al aneurisma de la trifurcación de la cerebral media. El último caso Hunt y Hess 3-4, no se ha podido operar hasta el momento. Los aneurismas fueron excluidos de la circulación mediante clipaje directo de su cuello, en los 2 casos de aneurismas de carótida en relación con la arteria comunicante posterior (CoP) se utilizó un único clip fenestrado de titanio en cada caso.

Fig. 16 y 17 Aneurisma de la Carótida
- CoP, antes y después de la colocación del clip fenestrado,
se respeta la carótida y se excluye totalmente el aneurisma.
se respeta la carótida y se excluye totalmente el aneurisma.
En el caso del aneurisma de la cerebral media se disecó el cuello
del mismo y se colocó un clip recto largo conservando la permeabilidad
de los vasos medios, sin embargo el paciente desarrolló déficit
circulatorio distal que se debió probablemente a espasmo arterial
sin poderlo comprobar. Al 4to de los casos operados, se le disecó
el cuello del aneurisma de la arteria Carótida Interna lzda -
arteria comunicante posterior., el cual impresionaba con implantación
frágil en la arteria madre y en el momento de colocar el clip
el aneurisma se desprendió de la misma teniendo que recurrir a
la oclusión de la arteria carótida proximal y distal al
sitio de implantación. Los casos de los aneurismas en relación
con la arteria CoP y cerebral media fueron abordados directamente por una
craneotomía pterigonal izquierda dado que los tres fueron de ese
lado y el aneurisma supraclinoideo por una vía transfrontal izquierda,
en los 4 casos se logró clipar el cuello del aneurisma, respetando
la circulación del vaso madre a excepción del que se desprendió
del mismo que hubo que sacrificar la circulación de forma completa.
De todos los aneurismas 5 fueron seculares (carótida y cerebral
media) y 2 fusiformes (sistema vertebro-basilar).
De los operados, uno fallecido, uno con hemiplejia derecha y dos sin déficit postoperatorio. De los tres no operados: uno fallecido, uno asintomático y el último bajo cuidado crítico esperando un recuperación de su grado de compromiso para ser operado, de tal manera que lo podemos considerar de manejo no quirúrgico para efectos de este trabajo.
Estos resultados están resumidos en la tabla a continuación, según sexo, edad, presentación clínica, ubicación topográfica de la lesión, tamaño, tratamiento quirúrgico o no, evolución clínica , y métodos diagnósticos.
De los operados, uno fallecido, uno con hemiplejia derecha y dos sin déficit postoperatorio. De los tres no operados: uno fallecido, uno asintomático y el último bajo cuidado crítico esperando un recuperación de su grado de compromiso para ser operado, de tal manera que lo podemos considerar de manejo no quirúrgico para efectos de este trabajo.
Estos resultados están resumidos en la tabla a continuación, según sexo, edad, presentación clínica, ubicación topográfica de la lesión, tamaño, tratamiento quirúrgico o no, evolución clínica , y métodos diagnósticos.
TABLA. 2 PRESENTACION DE SIETE CASOS
CLINICOS DIAGNOSTICADOS Y TRATADOS
EN EL SERVICIO DE NEUROCIRUGÍA DEL
HOSPITAL MÉXICO
CLINICOS DIAGNOSTICADOS Y TRATADOS
EN EL SERVICIO DE NEUROCIRUGÍA DEL
HOSPITAL MÉXICO
| No |
SEXO |
EDAD AÑOS |
CLíNICA |
UBICACIóN TAMAÑO |
CIRUGíA |
EVOLUCIÓN |
ESTUDIO |
| 1 |
M |
13 |
Asintomt. |
ART.CMI 3.5 cm |
clipaje cuello |
infarto Extenso CMI/muerte |
Tac, IRM ADS |
| 2 |
F |
65 |
HSA no déficit |
Art.CII -CoP 3cm |
clijape cuello oclusión Art.CII |
Infart. Hemis. Izdo. Despre- dimiento del aneurisma. Hemiplejia |
TAC, ADS |
| 3 |
M |
28 |
HSA Coma |
ART CII Bifur 3cm Art CID Art-CoP 1 cm |
no |
Hunt y Hess 3-4 |
TAC, ADS |
| 4 |
M |
17 |
HSA Pares Bajos y Hemiplejia Derecha |
Art. Basilar no 4cm |
no |
Muerte |
TAC, IRM |
| 5 |
M |
45 |
Disartría Pares Bajos IX, X, XI Somnolencia |
Art Basilar Megadólico -arteria |
no |
Integro/vigilanc |
TAC, AC |
| 6 |
F |
34 |
HSA No déficit |
Art. CII -CoP 2.5 cm |
clipaje |
Integra/vigilanc |
TAC, AC |
| 7 |
F |
43 |
HSA Hemiplejia Derecha, Estupor |
-Art. CII seg. Supra- clinoideo 2.5 cm |
clipaje |
Recuperación del 100% de sus funciones Integra/Vigilanc |
TAC, AC |
HSA:
Hemorragia subaracnoidea. AC: Angiografía convencional. ADS: Digital
sustraida
Discusión
A diferencia de la literatura donde se reporta una predominancia en mujeres, en este pequeño estudio predominaron los hombres por 1 caso. La edad de presentación, estuvo en promedio en la cuarta década de la vida como es esperado. Hubo cuatro casos de aneurismas de carótida, uno de cerebral media y dos del sistema vertebro-basilar. Los del sistema verte-brobasilar fueron fusiformes, comprometían casi todo el tronco de la basilar, estaban parcialmente trombosados ambos y se manifestaron con un síndrome compresivo de pares craneales a nivel del tronco cerebral, hechos comparables con la literatura mundial.


Fig. 18 y 19. IRM T2 corte axial
y Tl corte Sagital.
Aneurisma de la Basilar gigante parcialmente trombosado.
Aneurisma de la Basilar gigante parcialmente trombosado.


Fig. 20 y 21 . Angioresonancia cortes
axial y sagital que
demuestran el aneurisma parcialmente trombosado a nivel de
la arteria Basilar que compromete la irrigación posterior.
demuestran el aneurisma parcialmente trombosado a nivel de
la arteria Basilar que compromete la irrigación posterior.


Fig. 22 y 23. Arteriografía convencional, megadólico arteria a nivel de la Basilar, dilatación anormal, tortuosa desde su inicio.

En cinco casos restantes, hubo cuatro casos de la arteria carótida
interna y uno de la arteria cerebral media. Frecuencia que se comporta
relativamente a lo esperado por la grandes casuísticas.
Según la literatura, a nivel del complejo posterior se presentan
la 3era parte de los casos (33%), las otras dos terceras partes se dividen
como sigue: complejo anterior 10%, arteria carótida interna 29%,
seno cavernoso hasta 13% y arteria cerebral media 15%.


Predominó el planteamiento del abordaje directo y clipaje del cuello de los diferentes aneurismas, lográndose en cuatreo casos, con una evolución excelente en dos casos. Todos los aneurismas operados fueron seculares con cuello clipable según la angiografía convencional o digital sustraída. Los utilizados en el aneurisma supraclinoideo y un caso de la carótida en relación con la arteria comunicante posterior, fueron clips fenestrados de Yasargil que permitieron la integridad del vaso madre y facilitaron el clipaje del cuello.

El tamaño de los aneurismas en promedio fue de 2.68 cm de diámetro mayor, sin embargo cinco de los casos, tomando en cuenta la megadolicoarteria, estuvieron por encima de los 3 cm. Los hallazgos clínicos son compatibles con los reportados por la literatura sobresaliendo los síndromes pseudotumorales y los hemorrágicos.
Solo un caso de aneurismas múltiples, ambos de carótidas uno en la bifurcación de la carótida interna izquierda y otro de la carótida derecha en relación con la comunicante. Hasta en un 15% de los casos de aneurismas gigantes puede haber uno o más aneurismas en otros territorios. Fig. 30 y 31.
La importancia de la angiografía cerebral en el diagnóstico y tratamiento de esta patología fue determinante en la decisión del planteamiento quirúrgico, por cuanto establece una relación hemodinámica del flujo aneurismático y su vaso madre, el estado de la circulación colateral y distal al complejo lesión - vaso madre.
Conclusiones generales
Los aneurismas gigantes intracraneanos son infrecuentes y de gran dificultad técnico-quirúrgica. No hay un tratamiento totalmente efectivo en algunos casos. Existe gran morbilidad y mortalidad aún siendo operados. Su evolución natural es desfavorable. La gran mayoría se complican con sangrado subaracnoideo o síndromes de compresión sobre la base del cerebro, tallo cerebral y pares craneales. Se debe realizar en lo posible un tratamiento quirúrgico directo sobre el aneurisma según, las características y condiciones de cada caso. Los pacientes deben de ser completamente estudiados con Radiografías simples de cráneo, TAC, ATAC, ATAC helicodal, ADS y en los casos que se sospeche otro diagnóstico IRM.
Las diferentes técnicas directas o indirectas sobre el aneurisma con clipaje de su cuello, atrapamiento vascular con o sin bypass, técnicas endovasculares entre otras van a depender del adecuado análisis de todos estos métodos diagnósticos; pero la más importante apreciación sobre la posibilidad de clipar un aneurisma es su exploración directa.
Esta patología ocupa un lugar significativo en la investigación neuroquirúrgica, de modo que con el advenimiento de nuevos equipos y tratamientos se espera disminuir la complejidad de este tipo de cirugía y ofrecer mejores índices de curabilidad.
Bibliografía


Predominó el planteamiento del abordaje directo y clipaje del cuello de los diferentes aneurismas, lográndose en cuatreo casos, con una evolución excelente en dos casos. Todos los aneurismas operados fueron seculares con cuello clipable según la angiografía convencional o digital sustraída. Los utilizados en el aneurisma supraclinoideo y un caso de la carótida en relación con la arteria comunicante posterior, fueron clips fenestrados de Yasargil que permitieron la integridad del vaso madre y facilitaron el clipaje del cuello.


Fig. 28 y 29. Imagen del abordaje
quirúrgico de este caso, antes y después
del clipaje.
La microdisección del cuello permitió su oclusión total con un único clip recto.
La microdisección del cuello permitió su oclusión total con un único clip recto.
El tamaño de los aneurismas en promedio fue de 2.68 cm de diámetro mayor, sin embargo cinco de los casos, tomando en cuenta la megadolicoarteria, estuvieron por encima de los 3 cm. Los hallazgos clínicos son compatibles con los reportados por la literatura sobresaliendo los síndromes pseudotumorales y los hemorrágicos.
Solo un caso de aneurismas múltiples, ambos de carótidas uno en la bifurcación de la carótida interna izquierda y otro de la carótida derecha en relación con la comunicante. Hasta en un 15% de los casos de aneurismas gigantes puede haber uno o más aneurismas en otros territorios. Fig. 30 y 31.
La importancia de la angiografía cerebral en el diagnóstico y tratamiento de esta patología fue determinante en la decisión del planteamiento quirúrgico, por cuanto establece una relación hemodinámica del flujo aneurismático y su vaso madre, el estado de la circulación colateral y distal al complejo lesión - vaso madre.
Conclusiones generales
Los aneurismas gigantes intracraneanos son infrecuentes y de gran dificultad técnico-quirúrgica. No hay un tratamiento totalmente efectivo en algunos casos. Existe gran morbilidad y mortalidad aún siendo operados. Su evolución natural es desfavorable. La gran mayoría se complican con sangrado subaracnoideo o síndromes de compresión sobre la base del cerebro, tallo cerebral y pares craneales. Se debe realizar en lo posible un tratamiento quirúrgico directo sobre el aneurisma según, las características y condiciones de cada caso. Los pacientes deben de ser completamente estudiados con Radiografías simples de cráneo, TAC, ATAC, ATAC helicodal, ADS y en los casos que se sospeche otro diagnóstico IRM.
Las diferentes técnicas directas o indirectas sobre el aneurisma con clipaje de su cuello, atrapamiento vascular con o sin bypass, técnicas endovasculares entre otras van a depender del adecuado análisis de todos estos métodos diagnósticos; pero la más importante apreciación sobre la posibilidad de clipar un aneurisma es su exploración directa.
Esta patología ocupa un lugar significativo en la investigación neuroquirúrgica, de modo que con el advenimiento de nuevos equipos y tratamientos se espera disminuir la complejidad de este tipo de cirugía y ofrecer mejores índices de curabilidad.
Bibliografía
- Casasco A., Arnaud O., Gobin P, Aymard A., et al. Anévrysmes Géants Intracraniens. Traitement endovasculaire électif par Des spires métalliques. Neurochirurgie 38:18-26, 1992.
- David C, Vishteh G., Spetzler R., et al. Late angiographic follow-up review of surgically treated aneurysms. J Neurosurgery 91:396-401, 1999.
- Dietemann J L. IRM en la patología del encéfalo. Masson, S.A. Paris 1994, 1, 2, 176-182.
- Drake Ch G., Peerless SJ, Ferguson G G. Hunterian proximal arterial occlusion for giant aneurysms of the carotid circulation. JNeurosurgery 81: 656-665, 1994.
- Giannotta Steven and Litofsky Scott Reoperative management of intracranial aneurysms. J Neurosurgery 83:38 7-393, 1995.
- GruberA., KillerM., et al. Clinical and Angiographic Results of Endosaccular Coiling. Treatment of Giant and Very Large Intracranial Aneurysms: A 7-year, Single-center Experience. Neurosurgery 45:793-804, 1999.
- Gurian J H., Martín N A., Guglielmi G., et al Neurosurgical management of cerebral aneurysms following unsuccessful or incomplete endovascular ambolization. J Neurosurgery 83: 843-853, 1995.
- Hiroshi U, Hiroshi N., et al. Effects of Size and Shape (Aspect Ratio) on the Hemodynamics of Saccular Aneurysms: A Possible Index for Surgical Treatment of Intracranial Aneurysms. Neurosurgery 45: 119-130, 1999.
- Juvela Seppo, Porras Matti y Heiskanen Olli. Natural History of unruptured intracranial aneurysms: a long -term follow up study. J Neurosurgery 79: 174-182, 1993.
- Kassell N E, et al. The International Cooperative Study on the Timing of Aneurysm Surgery. Part I.- Overall management results. J Neurosurgery 73: 18-36, 1990.
- Kassell N E, et al. The International Cooperative Study on the Timing of Aneurysm Surgery. Part II: Surgical results. J Neurosurgery 73: 37-47, 1990.
- Kuzma B., and Goodman J Nonvisualization of known cerebral Aneurysm on MRA. Surg Neurol. 51:0-2, 1999.
- Lejkowitz M., Gobin R, Guglielmi G., et al. Ballon-assisted Guglielmi Detachable Coiling of Wide-necked Aneurysms: Part II Clinical Results. Neurosurgery 45:531-538, 1999.
- Ogilvy Christopher Giant Intracranial Aneurysms: Current Strategies of Management. MGH Neurovascular Homepage. http://neurosurgery. mgh. harvard. edu/
- Rhoton Albert L. Jr., M.D. Anatomy of Saccular Aneurysnis. Surg. Neurol. 14: 59-66, 1980.
- Sindou M. et Keravel Y. Les anévrysmes géants intracraniens. Approches thérapeutiques Societé de neuro-chirurgie de langue francaise, XXXIV Congrés Annuel Grenoble, 28-30 juin 1984. Neurochirurgie Vol. 30 Suppl. 1 1984 :1-128.
- Shibuya M, Sugita K Intracranial Giant Aneurysms. Youmans Neurological Surgery 4th Edition Williams and Wilkins. Baltimore, (54): 1310-1320. 1996
- Taveras Juan Manuel and John Pile-Spellman. Endovascular Therapeutic Neuroradiology. Neuroradiology 3th Edition Williams and Wilkins. Baltimore, U S.A. 1996
- Turtz A., Allen D., et al. Nonvisualization of a large cerebral aneurysm despite high-resolution magnetic Resonance angiography. Case report. JNeurosurgery 82: 294-295, 1995.
- Yasui N., Magarisawa S., et al. Subaracnoid Hemorrhage Caused by Previously Diagnosed, Previously Unruptured Intracranial Aneurysms: A Retrospective Analysis of 25 Cases. Neurosurgery 39:1096-1101, 1996
- Zouaoui A., Sahel M, Marro B., Clemenceau S., Capelle L., Marsault C. Three-dimensional Computed Tomographic Angiography in Detection of Cerebral Aneurysms in Acute Subarachnoid Hemorrhage. Neurosurgery 41:125-130, 1997.
* Médico residente, Neurocirugía, Universidad de Costa Rica, Hospital México
** Médico residente, Neurocirugía, Universidad de Costa Rica. Hospital México
*** Profesor asistente, Neurocirugía, Universidad de Costa Rica, Hospital México
**** Jefe de Clínica Neurocirugía, Universidad de Costa Rica, Hospital México
***** Jefe del Servicio de Neurocirugía, Universidad de Costa Rica, Hospital México. Departamento Neurocirugía, Universidad de Costa Rica, Hospital México, Costa Rica
Miguel A Mejía Rojas, Apdo. 1418-1000 San José, - Fax 2894921 - e-mail: mamejia@sol.racsa.co.cr